Kieruje Pracownią Biologii Bakteriofagów w Instytucie Biochemii i Biofizyki Polskiej Akademii Nauk. Zajmuje się biologią bakteriofagów, w szczególności ich strategiami przetrwania i unikania mechanizmów obronnych bakterii.

Kieruje Pracownią Mikrobiologii Stosowanej w Instytucie Biochemii i Biofizyki Polskiej Akademii Nauk. Jej zainteresowania badawcze to przede wszystkim molekularne mechanizmy bioaktywności bakterii kwasu mlekowego, w tym mechanizmy produkcji bakteriocyn.
Jeden z najpoważniejszych problemów, z jakimi borykamy się jako ludzkość, to antybiotykooporność. Według WHO, globalne zużycie antybiotyków wzrosło o 65% od 2000 do 2015 roku. W samej Unii Europejskiej co roku 35 000 osób umiera na zakażenia bakteriami uodpornionymi na antybiotyki. Naukowcy prześcigają się w pracach nad alternatywnymi sposobami walki z infekcjami bakteryjnymi. Poważni kandydaci to: terapia bakteriofagami oraz bakteriocynami. Rozmawiam o nich z naukowczyniami z Instytutu Biochemii i Biofizyki PAN: prof. Małgorzatą Łobocką i prof. Tamarą Aleksandrzak-Piekarczyk.
Dużym sprawcą problemu jest przemysł spożywczy. Antybiotyki dodawano do pasz dla zwierząt w tak dużych ilościach, że są teraz obecne w naszym środowisku, w glebie czy ściekach. Są tam w niedużym stężeniu, co sprawia, że bakterie w kontakcie z nimi nie giną, a uodparniają się. – Najczęściej oporność nie rozwija się podczas stosowania w lecznictwie. Kiedy stosujemy duże dawki antybiotyku, bakterie nie mają szansy się uodpornić – wyjaśnia prof. Aleksandrzak-Piekarczyk. Po prostu w czasie leczenia zostają zabite (dlatego tak ważne jest, by zażywać antybiotyk tak długo, jak nam zaleci lekarz – duża dawka jest ważna!).
Modyfikuje się znane antybiotyki, żeby bakterie nie umiały z nimi walczyć. Ewolucja bakterii jest jednak błyskawiczna, więc potrzebne są inne rozwiązania
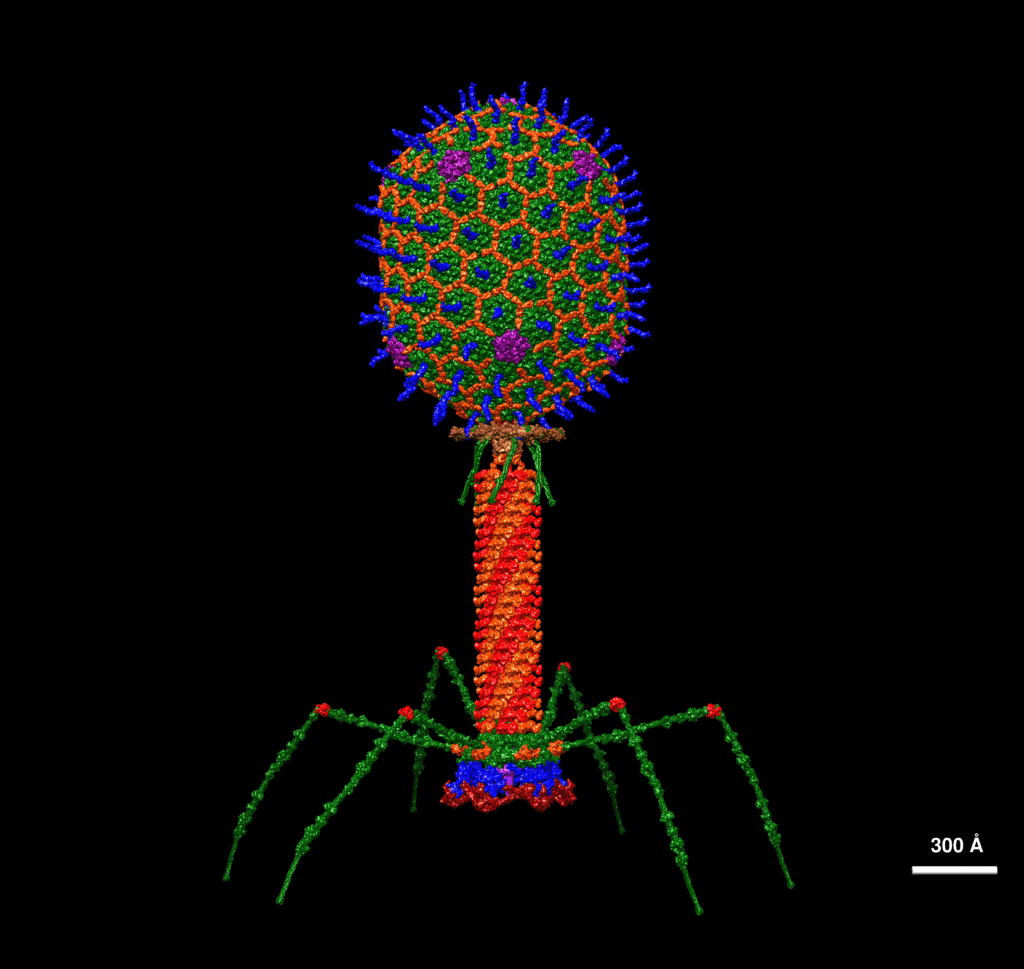
Bakteriofagi to wirusy, które infekują tylko bakterie. Co ważne, szczególnie dobrze działają bakteriofagi gronkowcowe: potrafią infekować aż 90% klinicznych szczepów gronkowca, bardzo opornego na antybiotyki. Bakteriofag wygląda jak mały lądownik kosmiczny: główka na długich nóżkach plus ogonek. Przyczepia się do bakterii, robi dziurkę w jej osłonie komórkowej i wstrzykuje do środka swoje DNA, po czym się tam namnaża. Zainfekowana bakteria w końcu pęka i uwalnia kolejne bakteriofagi. W niektórych krajach, np. w Gruzji, od dawna stosuje się bakteriofagi w medycynie, np. w preparatach dermatologicznych. Stosuje się je też w przemyśle spożywczym, np. serowarskim. – Bakteriofagi są niesamowicie różnorodne – opowiada prof. Łobocka. Można je więc bardzo precyzyjnie dobrać do zwalczania konkretnych bakterii, a jednocześnie nie szkodzą innym (np. tym dobrym z naszego układu trawiennego).
Inne możliwe rozwiązanie to bakteriocyny. To białka produkowane przez bakterie, łatwo degradowalne, więc nie ma ryzyka, że nagromadzą się w środowisku i spowodują antybiotykooporność. Stosuje się je w przemyśle spożywczym, np. konserwant E234 to nizyna, bakteriocyna produkowana przez bakterie kwasu mlekowego, dzięki której sery nie psują się pod wpływem bakterii masłowych. W medycynie nadają się do stosowania miejscowego na skórę, pracuje się też nad stosowaniem doustnym. Ich zaletą jest brak lub niewielka toksyczność dla ludzkich komórek.
Posłuchajcie, to odcinek z pierwszej linii fontu nauki!
TRANSKRYPCJA
Karolina Głowacka: W studio Radia Naukowego pani profesor Małgorzata Łobocka. Dzień dobry, pani profesor.
Małgorzata Łobocka: Witam serdecznie.
K.G.: Pani profesor zarządza Pracownią Biologii Bakteriofagów w Instytucie Biochemii i Biofizyki Polskiej Akademii Nauk. W tym samym instytucie kieruje Pracownią Mikrobiologii Stosowanej. W studio jest również obecna pani Tamara Aleksandrzak-Piekarczyk. Dzień dobry.
Tamara Aleksandrzak-Piekarczyk: Dzień dobry, witam wszystkich.
K.G.: Będziemy mówiły o palącym problemie antybiotykooporności i o sposobach walki z tym problemem, nad którymi obie panie pracują. Na początek garść statystyk – w latach dwa tysiące-dwa tysiące piętnaście globalne stosowanie antybiotyków wzrosło o sześćdziesiąt pięć procent. Niedawno „The Lancet” opublikował pracę, w której szacowano, że na świecie w dwa tysiące dziewiętnastym roku z powodu bakterii opornych na antybiotyki zmarło ponad milion dwieście tysięcy osób, a w przypadku niemal pięciu milionów zgonów taka infekcja była przynajmniej częściowo powodem śmierci. Czy cofniemy się do ery przed antybiotykami?
T.A.P.: Są ku temu podstawy. Nie chcemy straszyć, ale sytuacja nie jest optymistyczna i nie napawa nas nadzieją, że będzie lepiej. Pomimo prewencji, która jest stosowana w tej chwili, właściwie z roku na rok jest coraz gorzej. Nowe dane pokazują, że na świecie, również w Polsce, jest coraz więcej przypadków antybiotykooporności. Szacuje się, że w Unii Europejskiej rokrocznie mamy około trzydziestu pięciu tysięcy zgonów z powodu bakterii, których nie da się usunąć za pomocą standardowych terapii, nawet terapii antybiotykami tzw. ostatniej szansy, ponieważ niektóre z tych bakterii się na nie uodporniły. W dodatku są uodpornione na standardowo stosowane antybiotyki, więc są to w tej chwili szczepy wielolekooporne. Musimy działać, żeby ograniczyć ten proceder narastania oporności bądź pomóc zwalczać te bakterie w jakiś inny sposób niż antybiotykoterapią.
K.G.: Czy to znaczy, że mówimy o takiej sytuacji, że np. angina czy bakteryjne zapalenie płuc będą trudne do wyleczenia?
M.Ł.: Może tak być. Zresztą podłoże tych chorób niekoniecznie jest takie samo. Angina jest chorobą bakteryjną, ale też najczęściej powodują ją paciorkowce. Natomiast wśród paciorkowców również pojawiły się szczepy antybiotykooporne i jak tylko będziemy stosować antybiotyki w większej liczbie, to one będą się coraz bardziej rozprzestrzeniać. Bo tutaj działa prosta zasada selekcji – jeżeli nie ma antybiotyku, to wszystkie bakterie rosną w tym środowisku. Natomiast, jeśli pojawia się antybiotyk i trafi się jakiś jeden oporny szczep wśród tych rosnących, to oczywiście antybiotyk zabije wszystkie wrażliwe, a te oporne będą się swobodnie namnażały. I tutaj problem polega nie tylko na tym, że bakterie się adaptują do nowych warunków, czyli środowiska z antybiotykami w mniej więcej taki sam sposób, jak inne organizmy, ale też dodatkowo mogą się dzielić tą antybiotykoopornością.
K.G.: W ramach jednego gatunku czy także pomiędzy?
M.Ł.: I w ramach jednego, i w ramach różnych, i pomiędzy rodzajami. Bakterie mają coś takiego jak ruchoma pula genów. Elementy związane z jej przenoszeniem mogą się przenosić pomiędzy bakteriami – i to pomiędzy bakteriami w obrębie gatunku, ale też w obrębie rodzaju, a czasem nawet między rodzajami. Są nawet przypadki, że między bardziej odległymi taksonomicznie grupami bakterii. Przy czym o ile dana cecha daje jakieś korzyści bakteriom, to oczywiście te, które ją pozyskały, będą się namnażały. Gdyby nie było antybiotyków, bakteria, która pozyskała taką cechę, właściwie byłaby tak samo silna w konkurencji z innymi bakteriami, nie byłaby lepsza. Natomiast w momencie, kiedy pozyskała tę odporność i kiedy jest w środowisku z antybiotykiem, lepiej sobie z tym radzi. Przeżywa i się namnaża, bo ma nowe miejsce, w którym poprzednio były bakterie wrażliwe, a teraz ich tam nie ma.
K.G.: Na szczęście są alternatywy wobec antybiotyków – bakteriofagi, bakteriocyny – i o nich będziemy dokładnie mówić. Natomiast na początek chciałabym poprosić panie o opowiedzenie, jak działają klasyczne antybiotyki, jakie mamy ich rodzaje, jak działa ten mechanizm nabywania lekooporności przez bakterie.
T.A.P.: Mamy kilka klas antybiotyków w zależności od ich mechanizmu działania i struktury chemicznej. Jeżeli chodzi o mechanizmy działania, to możemy je podzielić na dwie główne grupy, czyli antybiotyki, które działają na otoczkę bakterii w znaczeniu błony komórkowej bądź ściany komórkowej, i antybiotyki, które mają cele wewnątrz komórki – czyli żeby odpowiednio zadziałały na bakterię, muszą być przetransportowane do wnętrza komórki. Jeżeli chodzi o antybiotyki, które działają na otoczkę komórki, wyróżniamy te, które działają na blokadę syntezy ściany komórkowej wobec ściany komórkowej – bakteria nie jest w stanie funkcjonować. Ściana komórkowa jest taką mechaniczną ochroną bakterii przed ciśnieniem osmotycznym, po prostu komórka bez ściany komórkowej lizuje…
M.Ł.: Pęka, tak jak balonik nadmuchany w pudełku. Jeżeli bardzo go nadmuchamy, to to pudełko będzie go chroniło przed pęknięciem. Natomiast jeżeli rozerwiemy to pudełko, to balonik natychmiast pęknie.
K.G.: Czyli ta bakteria się tak rozlewa.
T.A.P.: Tak. Z bakterii zostają tzw. protoplasty, czyli obłonione twory z dużym ciśnieniem wewnątrz.
M.Ł.: Musi być przeciwdziałanie z zewnątrz temu ciśnieniu. Jest ono zapewniane przez sztywną ścianę komórkową.
T.A.P.: Tak. Jeżeli mamy antybiotyk, który zniszczy mechanizmy syntezy tej ściany komórkowej, to bakteria nie jest w stanie bez tego funkcjonować. Wśród tej grupy mamy penicyliny, czyli pierwsze antybiotyki odkryte w latach dwudziestych zeszłego stulecia przez Alexandra Fleminga. One funkcjonują również obecnie, są to do dzisiaj stosowane, w miarę bezpieczne antybiotyki dla człowieka. Mamy również antybiotyki, które działają bezpośrednio na błonę komórkową, tworząc w niej kanały – są różne mechanizmy działania tych antybiotyków. Efekt tego jest taki, że wyciekają substancje wewnątrzkomórkowe na zewnątrz i kończy się to śmiercią komórki. Jeżeli chodzi o grupy antybiotyków, które działają na cele wewnątrzkomórkowe, to mamy antybiotyki, które hamują różne podstawowe procesy niezbędne do funkcjonowania komórki typu replikacja DNA, transkrypcja bądź translacja. Tutaj również mamy wiele grup w zależności od poziomu, na którym działają. Narastanie oporności polega w tym przypadku na modyfikacji celu działania antybiotyku, czyli np. modyfikacji białka, z którym się wiążą. Jeżeli będzie inna struktura tego białka, to antybiotyk się nie zwiąże i nie zadziała, więc bakterie się tak ratują. Natomiast, jeżeli chodzi o antybiotyki, które działają na zewnątrz komórki, czyli na tę otoczkę komórkową, to mamy tutaj np. modyfikacje składu błony komórkowej. Jeżeli skład zostanie nieco zmodyfikowany, to wtedy antybiotyk może nie mieć powinowactwa albo mieć utrudnione powinowactwo do takiej błony komórkowej, nie może tam za bardzo integrować. Generalnie na tym polegają mechanizmy oporności. Są one przenoszone na elementach genetycznych.
K.G.: Zapytam naiwnie – czy skoro bakterie się uodpornią na jeden, drugi, trzeci, czwarty antybiotyk, to czy nie możemy stworzyć piątego, szóstego, siódmego, trzydziestego itd.? Jest jakieś ograniczenie?
M.Ł.: Ograniczeń jest wiele. Przede wszystkim najlepiej korzystać z tych antybiotyków, które już znamy, i modyfikować je tak, żeby np. enzymy bakterii, które się rozwinęły w kierunku rozkładu tych antybiotyków, nie działały na takie zmodyfikowane formy. Działają tak m.in. antybiotyki beta-laktamowe nowej generacji, że po prostu enzymy, które się wykształciły przeciwko nim, nie działają. Kolejna możliwość to dodawanie do antybiotyków inhibitorów białek, które rozkładają u bakterii te antybiotyki. Działa tak np. kwas klawulanowy dodawany do antybiotyków z grupy beta-laktamów – po prostu hamuje działanie bakterii innej beta-laktamazy. Jeżeli jemy beta-laktamy, które mogą być rozkładane przez beta-laktamazy, razem z kwasem klawulanowym, to wtedy jest zabezpieczenie przed działaniem tych enzymów bakteryjnych, które rozkładają ten antybiotyk, np. znany Augmentin zawiera kwas klawulanowy. Dodatkowo mamy wiele mechanizmów bakteryjnych zabezpieczających dlatego, że bakteria może wytworzyć struktury, które nie wiążą antybiotyku. Może zablokować jego transport, może stworzyć albo wykształcić czy wzmocnić mechanizmy, które wypompowują antybiotyk z komórki. Może też wytworzyć enzymy, które antybiotyk rozkładają. Bardzo często taka oporność na wysokie dawki antybiotyków jest typem oporności złożonej. Mamy nie tylko enzym, który rozkłada antybiotyk, ale także wykształcenie pomp, które go wypompowują, i mamy również zmianę powinowactwa struktur.
K.G.: Opisała pani, jak one działają, i to jest szalenie cenne, natomiast wydawałoby się, że najprostszym pomysłem jest zrobienie nowych antybiotyków.
T.A.P.: Nie mamy nieskończonej liczby możliwości. W tej chwili jest kilkanaście klas tych antybiotyków, natomiast nie możemy ich wyszukiwać w nieskończoność, bo po pierwsze bardzo wiele nowych klas antybiotyków jest po prostu toksycznych dla komórek eukariotycznych, czyli dla nas. To jest taka gra pomiędzy toksycznością dla bakterii, dla komórek ludzkich czy zwierzęcych. Wiadomo, że antybiotyki mają pewną cytotoksyczność, ale są bardziej toksyczne dla komórek bakteryjnych niż ludzkich, dlatego są stosowane np. w lecznictwie. Ale bardzo duża część produkowanych przez bakterie, przez grzyby substancji antymikrobiologicznych ma bardzo dużą toksyczność i nie nadaje się do użycia. Po drugie każde wprowadzenie na rynek nowego antybiotyku jest potężnym kosztem dla firm. Jest czasochłonne, kosztochłonne. Okazuje się, że po wprowadzeniu takiego antybiotyku na rynek już po kilku miesiącach mamy oporność.
K.G.: Błyskawicznie.
T.A.P.: Tak, często jest to błyskawiczne w dzisiejszych czasach ze względu na to nadużywanie antybiotyków, na stosowanie ich w hodowli, błyskawicznie się to rozprzestrzenia. Antybiotyki znajdują się w środowisku, w glebach, w ściekach i prowadzi to do potężnego ryzyka rozwoju antybiotykooporności, ponieważ one się nie znajdują tam w wysokich stężeniach.
K.G.: Czyli działa to dla nich trochę jak szczepionka, tak sobie to wyobrażam.
T.A.P.: Można tak powiedzieć. One, mając te niewielkie stężenia, potrafią przeżyć, przy okazji uodparniając się na nie – na tym polega mechanizm rozwijania oporności. Najczęściej ta oporność nie rozwija się podczas stosowania w lecznictwie. Kiedy stosujemy duże dawki antybiotyku, bakterie nie mają za bardzo szansy się uodpornić. Po prostu to duże stężenie od razu je zabija. Natomiast, jeżeli mamy w glebach, w ściekach, w środowisku niewielkie stężenia tych antybiotyków bądź kiedy pacjent np. ich nie stosuje…
K.G.: Właśnie miałam powiedzieć, że chyba że ktoś się lepiej poczuje i odstawia.
T.A.P.: Tak, ale głównie jest to problem środowiskowy.
K.G.: I wykorzystania w rolnictwie, w hodowlach zwierząt.
T.A.P.: Tak, aczkolwiek mamy w tej chwili oporności na antybiotyki, które nawet nie są wykorzystywane w rolnictwie, np. ten gen New Delhi, który daje oporność na karbapenemy. On właściwie nie powinien być wykorzystywany w hodowli. Co prawda oporność przyszła z Indii, nie wiadomo, co się tam dzieje. My mamy dość ścisłe regulacje w Unii Europejskiej, natomiast nie wiadomo, co się dzieje w państwach Trzeciego Świata itd., jak te antybiotyki są tam stosowane.
K.G.: Mówiła też pani o antybiotykach ostatniej szansy. Rozumiem, że są to antybiotyki wykorzystywane bardzo rzadko, żeby jak najmniej tych bakterii się na nie uodporniło?
T.A.P.: Tak. Właśnie te karbapenemy w tej chwili są antybiotykami ostatniej szansy, które są zachowywane tylko dla takich skrajnych przypadków, gdzie mamy już szczepy, na które żadne inne antybiotyki nie działają. Mieliśmy więcej tych antybiotyków ostatniej szansy, np. wankomycyna, ale okazało się, że mamy oporne na nią enterokoki i inne bakterie, więc nie ma już ona takiego statusu. Natomiast karbapenemy ciągle mają, pomimo tego, że niestety pojawiły się geny oporności, np. ten gen New Delhi. Daje on oporność na karbapenemy. Jest to gen kodujący beta-laktamazę, czyli rozkładający taki zmodyfikowany pierścień beta-laktamowy w tym karbapenemie. Karbapenemy należą do grupy antybiotyków beta-laktamowych, więc też mają taki pierścień, natomiast był on trochę zmodyfikowany i dzięki temu one przez długi czas działały na bakterie. Ale w ostatnich latach się to skończyło. Karbapenemy są stosowane już od lat osiemdziesiątych. Oporność przyszła z Indii, ale mamy też geny, które przychodzą np. z Włoch.
M.Ł.: Te bakterie migrują i w związku z tym, jeżeli mamy jakiegoś pacjenta czy nawet turystę, który przyjechał, miał zakażenie, trafił do szpitala albo nawet nie trafił – chociaż najczęściej to przekazywanie bakterii antybiotykoopornych następuje w szpitalach dlatego, że tam jest zgromadzenie ludzi, którzy są chorzy, są podatni, a jednocześnie często są razem w salach i różnie z tą higieną bywa.
K.G.: Czyli mamy kłopot również przez podróże i tę słynną globalizację.
M.Ł.: Oczywiście. Zresztą COVID-19 też się rozsiał z tego powodu. Gdybyśmy nie podróżowali, gdyby Włosi nie zatrudniali masowo Chińczyków, to być może w ogóle nie byłoby COVID-u w Europie.
K.G.: O ile rozumiem, antybiotyki działają też trochę jak tsunami – dlatego musimy brać te leki osłonowe, te dobre bakterie podczas lub tuż po antybiotykoterapii. Więc to też jest kolejny kłopot. A które z bakterii uodparniają się szczególnie szybko? Zdaje się, że gronkowiec złocisty jest jednym z takich negatywnych bohaterów.
M.Ł.: Jest grupa bakterii zaliczanych do tzw. klasy ESKAPE. To jest kilka grup bakterii, które szczególnie szybko nabywają oporność na antybiotyki. Wśród nich jest Klebsiella, są Enterobacteriaceae, czyli enterobakterie, jest Acinetobacter baumannii, która się świetnie przechowuje w różnych miejscach w szpitalach, jest Enterococcus i gronkowiec złocisty.
K.G.: Zdaje się, że ten Acinetobacter jest szczególnie groźny w szpitalach, prawda?
M.Ł.: Tak – dlatego, że jest to bakteria, która sobie tam siedzi np. na końcówkach kranów, przewodach szpitalnych. Nie w wentylacji, ale właśnie na tych wszystkich doprowadzeniach wody.
K.G.: Jeden z patronów zapytał: „Jak realnie dużym zagrożeniem jest pandemia choroby wywołanej przez bakterię antybiotykooporną? Jak bardzo powinniśmy się bać?”. To takie skojarzenie przy okazji COVID-u, o którym panie mówiły.
M.Ł.: Wydaje mi się, że to zależy od bakterii, od naszej higieny. Najgorszymi zakażeniami są te związane z wodą i żywnością dlatego, że wszyscy pijemy wodę i jemy. Kolejna rzecz to brudne ręce, przy czym wydaje mi się, że epidemia COVID-u wykształciła trochę w ludziach nawyk mycia rąk. Nawet jak się idzie do miejskiej toalety, to widać, że ludzie myją te ręce jakoś lepiej niż kiedyś. Kiedyś zanurzali końcówki palców pod strumieniem wody, a w tej chwili myją ręce dość dobrze. No i oczywiście droga wziewna – wirusy najczęściej się rozprowadzają tą metodą, przy czym były nawet kiedyś takie wyliczenia – na jaką odległość w czasie oddechu czy rozmowy są wyrzucane bakterie. Była mowa o dwudziestu paru centymetrach. Więc jeżeli rozmawiamy z kimś chorym i odsuniemy się na większą odległość, to jest to pewien sposób zabezpieczenia.
K.G.: Wirusy są lżejsze, więc pewnie docierają na większą odległość.
M.Ł.: Tak. Poza tym jest to też zależne od cyrkulacji powietrza. Jeżeli mamy wentylowane pomieszczenie, to powietrze cyrkuluje i te bakterie też są jakby mieszane z powietrzem. Zależy to też od dawki zakaźnej. Każda bakteria ma jakąś dawkę zakaźną. Jak jedna sztuka bakterii spadnie nam na oko czy język, to nasz układ immunologiczny raczej sobie poradzi. Natomiast, jeżeli to jest duża dawka, to jest już gorzej. Dla różnych bakterii nawet te dawki zakaźne są w jakiś sposób określone. Jeżeli robimy np. badania moczu, to jest określona liczba bakterii, która jest już uważana za stan zapalny, zakażenie. Natomiast poniżej tej liczby uważa się, że jest to stan normalny, ponieważ w moczu zawsze są jakieś bakterie. Jeżeli jest ich tam więcej, to jest to już sytuacja zagrażająca chorobą.
K.G.: Jakie są światowe strategie walki z antybiotykoopornością? Jedna z patronek, pani Aleksandra, pyta: „Czy lekarze dostają informacje o tym, jakich substancji nie przepisywać?”. Czy mamy jakieś ogólne zalecenia? Bo zanim się stworzy w masowy sposób alternatywę, to trzeba hamować to, co się dzieje.
T.A.P.: Tak, mamy przede wszystkim zalecenia, żeby lekarze ograniczali liczbę przepisywanych antybiotyków, żeby nie poddawali się presji pacjentów. Chodzi o to, żeby stosować antybiotyki wyłącznie przy chorobach bakteryjnych, nie wirusowych. Oczywiście nie można stosować ich na własną rękę, nie powinno się przerywać terapii antybiotykowej, jeżeli lekarz tego nie zalecił, stosować antybiotyki, na które oporności narastają najtrudniej i najwolniej. Są to też takie parametry, które muszą spełnić państwa Unii Europejskiej.
K.G.: A co z tym rolnictwem, z hodowlą zwierząt?
T.A.P.: W rolnictwie też zostały wprowadzone nowe przepisy, które mówią, że każde podanie antybiotyku musi być ściśle zapisane, regulowane. Rolnicy muszą prowadzić dzienniki, w których musi być zapisana każda wizyta weterynarza z podaniem antybiotyku, to, w jakiej dawce był on podany itd.
K.G.: A co było wcześniej?
T.A.P.: Wolna amerykanka.
M.Ł.: Dodawano antybiotyki do pasz, żeby kurczaki szybciej przybierały na masie mięśniowej.
T.A.P.: Tak, w tej chwili jest to zakazane. Były kiedyś także podawane hormony na wzrost – to też już dawno zostało zakazane.
K.G.: Jak rozumiem, jest taki globalny wyścig z czasem. To znaczy, na ile da się ograniczyć to zjawisko antybiotykooporności, a jednocześnie znaleźć alternatywy. Chciałam teraz przejść właśnie do alternatyw, bo to nie są nowe rzeczy, tylko wydaje mi się, że one zyskują w ostatnich latach na popularności. Może zacznijmy od bakteriofagów, które uwielbiam – one wyglądają tak ikonicznie i kosmicznie. [śmiech]
M.Ł.: Tak. [śmiech] Co prawda nie wszystkie, ale znakomita większość tak wygląda. Muszę tu wspomnieć, że tzw. bakteriofagi ogonkowe to są wirusy, tylko one specyficznie infekują bakterie. Nie infekują w ogóle komórek wyższych organizmów człowieka, zwierząt, roślin. Jest ich najwięcej spośród istnień na Ziemi, są dominujące. Mało tego – one pojawiły się najwcześniej w ewolucji. Uważa się, że pojawiły się jeszcze przed oddzieleniem się bakterii od tzw. archeonów. I to są właśnie te bakteriofagi, które mają taki ciekawy wygląd, jak sputniki księżycowe. Czyli taka dwudziestościenna regularna główka, ogonek i bardzo często tzw. włókno ogonka, które wyglądają jak nóżki pajączka. Można zaobserwować, że taki bakteriofag może się przemieszczać na tych nóżkach po powierzchni komórki, ale na zasadzie czysto fizycznej. Mianowicie do jego trwałego przytwierdzenia dochodzi, kiedy przytwierdzą się co najmniej trzy nóżki. Jeśli przytwierdziła się jedna, dwie, to pozostałe mogą się przemieszczać i odrywać od tego miejsca. Ale generalnie bakteriofagi mają powinowactwo do komórek bakteryjnych. Mogą penetrować osłony tych komórek i wprowadzać do nich swoje DNA. Ale bakteriofagi są specyficzne względem bakterii określonych gatunków, rodzajów, przy czym nigdy nie jest tak, że wszystkie szczepy danego gatunku są infekowane przez bakteriofaga, który infekuje jakieś szczepy danego gatunku. Bakteriofagi mają różne spektrum infekcyjności. Czasem infekują tylko niektóre szczepy danego gatunku bakterii, czasem infekują ich dużo. Szczególnie korzystne w zastosowaniach antybakteryjnych wydają się bakteriofagi gronkowcowe dlatego, że są wśród nich takie, które infekują nawet dziewięćdziesiąt procent szczepów klinicznych, wyizolowanych z różnych źródeł, od pacjentów. I to jest ich niesamowita przewaga.
K.G.: To, że one są specyficzne, czyli że wyspecjalizowały się w atakowaniu konkretnych bakterii, powoduje, że nie działają jak tsunami, jak klasyczny antybiotyk, tylko możemy wybrać, którego chcemy użyć?
M.Ł.: Tak, to jest olbrzymia zaleta dlatego, że naszym problemem po każdej antybiotykoterapii jest to, że leczymy się po antybiotyku, ponieważ nasz organizm jest wyjałowiony z bakterii tzw. komensalnych. Trzeba pamiętać, że bakterie robią mnóstwo dobrego. Według niektórych wyliczeń mamy więcej komórek bakterii w swoim organizmie niż naszych własnych. Mamy je w przewodzie pokarmowym, w układzie moczowym, na skórze. To, co wydalamy, to są głównie bakterie. Bakterie produkują mnóstwo rzeczy, które są nam potrzebne, np. witaminę K, niektóre witaminy z grupy B, nawet witaminę C. Poza tym produkują wiele substancji, które działają na nasz organizm stymulująco, np. stymulują do produkcji neuroprzekaźników albo same je produkują. Trzeba pamiętać, że nie spotkaliśmy się z bakteriami teraz, w czasie rozwoju cywilizacji. One współistnieją z nami właściwie od zarania ludzkości. Nasz organizm się świetnie przystosował do bakterii, a bakterie do naszego organizmu. Zawsze biologiczną rolą bakterii i wirusów jest rola podobna do roli drapieżników, czyli głównie atakowanie słabych osobników, eliminowanie ich z populacji. Przy czym ta słabość może być stała, jeżeli np. ktoś ma obniżoną odporność immunologiczną, ale może być też czasowa. Jeżeli ktoś jest po jakimś wypadku, po rekonwalescencji, wtedy jest szczególnie podatny. W cywilizowanym świecie poziom stresu jest taki, że duża część społeczeństwa jest prawie permanentnie wrażliwa na infekcje z powodu wysuszenia śluzówek, powietrza w klimatyzowanych pomieszczeniach, przesuszenia. Te wszystkie nienaturalnie zmienione powierzchnie ciała są podatne na infekcje. Są to również wrota infekcji do wnętrza organizmu. W jamie ustnej są różne wydzieliny, np. lizozym – enzym, który mamy w łzach, w ślinie, na skórze i który rozbija, lizuje bakterie. Ale jeżeli to nie zadziała, to mogą się one przedostać głębiej do układu oddechowego, pokarmowego. Przy czym w układzie pokarmowym mamy mnóstwo bakterii, ale w układzie oddechowym, jeżeli jest ich za dużo i jeżeli są to bakterie chorobotwórcze, to już jest problem. Jest też spora populacja osób z mukowiscydozą, które mają dużo wydzieliny stającej się idealnym siedliskiem rozwoju bakterii. Na podstawie badań genetycznych zdiagnozowano u Chopina, że miał on mukowiscydozę i zmarł właśnie na to, a nie na gruźlicę.
K.G.: Mogłaby pani opowiedzieć, w jaki sposób bakteriofagi atakują bakterie? Bo to jest dość spektakularna strategia.
M.Ł.: Jeżeli bakteriofag zetknie się z komórką mającą receptory dla struktur tzw. płytki podstawnej tego bakteriofaga – to są struktury na końcu ogonka, które przytwierdzają się do bakterii – to przytwierdza się on do osłon komórkowych bakterii. W tzw. szpilce ogonka znajduje się enzym, który jest w stanie wytrawić dziurkę w ścianie komórkowej. Po jej wytrawieniu i po przebiciu się przez wewnętrzną błonę komórkową wprowadzane jest DNA bakteriofaga, czyli cała reszta. Kapsyd białkowy zostaje na zewnątrz, natomiast w środku jest tylko DNA. Informacja genetyczna jest wstrzyknięta. Czasem z tą informacją jest wstrzykniętych jeszcze kilka białek, które mają za zadanie np. ochronić tę informację genetyczną przed działaniem mechanizmów obronnych bakterii. Dlatego, że bakterie mają wiele mechanizmów obronnych, które zapobiegają dostaniu się takiego obcego DNA. I nie tylko bakterie, komórki ludzkie zresztą też. Komórki wykształciły wiele białek, które rozpoznają tylko określony typ DNA, czyli ich DNA, bo ono jest w jakiś konkretny sposób zmodyfikowane. Ma do konkretnych sekwencji przyczepione np. grupy metylowe. Enzymy własne, czyli bakterii, uznają – to oczywiście antropomorfizm – że jak te grupy metylowe tam są, to one tego nie trawią. Jeżeli DNA bakteriofaga nie jest zmodyfikowane, to on nie ma szans, bo to DNA zostaje strawione. Chyba że wstrzyknął razem ze swoim DNA białka, które np. chronią przed tymi enzymami. Mogą chronić w różny sposób – poprzez pokrycie tego DNA, poprzez zablokowanie działania tych systemów trawiących DNA. Oczywiście wszystko w biologii jest ilościowe. Bo jak jeden bakteriofag zainfekuje komórkę, to te enzymy sobie poradzą. Natomiast, jeżeli mamy dużo bakteriofagów i wszystkie się rzucą… Może nie powinnam mówić „rzucą”, bo działa to na zasadzie powinowactwa…
K.G.: Czym jest powinowactwo?
M.Ł.: To jest zdolność do przyczepienia się, do rozpoznania – tak jak zamek i klucz. Upraszczając, możemy powiedzieć, że klucz ma powinowactwo tylko do określonego zamka, pasuje tylko do niego. To samo można powiedzieć na temat struktur tych płytek ogonków bakteriofagów, że one pasują do określonych struktur na powierzchni danej bakterii. I dlatego przyczepiają się tylko do określonych bakterii, bo tylko do nich mają to powinowactwo.
K.G.: Czyli musi być więcej sztuk bakteriofagów w stosunku do bakterii, żeby doszło do skutecznego…
M.Ł.: Niekoniecznie. Tylko w sytuacji, kiedy bakteriofag nie ma zabezpieczeń przed tym trawieniem przez enzymy komórkowe. Operujemy w świecie biologii – każdy organizm ma zdolności adaptacyjne. Bakteria próbuje się zaadaptować do tego, że w środowisku są bakteriofagi, które jej zagrażają, i wykształca mechanizmy oporności. No ale z kolei bakteriofagi, nie mogąc zainfekować bakterii, która jest oporna, działają również na zasadzie selekcji. Jeżeli przypadkiem w którymś bakteriofagu wykształciła się jakaś cecha, np. zmiana w tych strukturach płytki podstawnej, która powoduje, że on może się adsorbować do takiej bakterii, która stała się odporna, to on się adsorbuje, wstrzyknie tam swoje DNA, namnoży się i jego potomstwo będzie takie samo, i będzie mogło się adsorbować do tych opornych bakterii. Więc to jest taka walka, klasyczna ewolucja typu drapieżnik-żywiciel.
K.G.: A czy to jest tak, że te namnażające się DNA w komórce bakterii jakoś ją potem rozrywają?
M.Ł.: Oczywiście. Pełny rozwój bakteriofaga wygląda w ten sposób, że potem, jak się to DNA znajdzie w komórce, ulega powieleniu, czyli replikacji. Następnie te powielone cząsteczki stają się materiałem dla przepisywania na informacyjne RNA, a informacyjne RNA jest matrycą do translacji białek. Białka fagowe, które powstają, tworzą struktury dorosłego bakteriofaga, przy czym to strasznie fajnie wygląda dlatego, że te bakteriofagi, już w pełni ukształtowane, są w komórce i w momencie, kiedy są już złożone… Bo najpierw się składa główka, ogonki składają się oddzielnie, do główki pakowane jest DNA i potem ogonki są doczepiane. Jak to wszystko jest gotowe, to uaktywniają się białka bakteriofaga, które mają zdolność do tzw. lizy, czyli do uszkodzenia osłon komórkowych bakterii. I jak mówiłam, komórka bakteryjna jest jak mocno napompowany balonik, który jest w twardej, sztywnej skrzyneczce. Póki ta skrzyneczka tam jest, balonik nie pęknie. W związku z tym jak działają enzymy bakteriofaga? Robią one maleńkie dziurki w tym baloniku, czyli w tych wewnętrznych błonach, po czym główne białka lityczne, czyli takie, które mają zdolność do trawienia tej ściany komórkowej, wydostają się przez te dziurki i trawią. W momencie, kiedy ściana komórkowa jest uszkodzona, pęka pod ciśnieniem. Wygląda to dosyć spektakularnie – jak takie pękające baloniki, z których się wylewa zawartość. Przy czym różne bakterie mogą pękać jednolicie, czasem pękają tylko na jednym końcu. Ale suma summarum wydostają się z tego potomne bakteriofagi. Może ich być kilka, kilkanaście, kilkadziesiąt, nawet kilkaset w niektórych przypadkach. To też zależy od wielkości, bo są bakteriofagi mniejsze, większe. Komórka Escherichia coli ma średnio jeden, dwa mikrony długości. Natomiast średnica główki bakteriofaga może wynosić dwadzieścia, sto nanometrów. One się zaliczają do nanostruktur. To jest zupełnie inna skala, więc mogą być tam dosyć gęsto upakowane. Czasem to wygląda spektakularnie, jak tacy ludzie w śpiworach ułożeni obok siebie.
K.G.: Są tego zdjęcia?
M.Ł.: Tak, ale nie ma ich wcale dużo dlatego, że robienie tego typu zdjęć wymaga bardzo wyrafinowanych technik mikroskopii, biologii molekularnej, preparowania.
K.G.: Poszukam czegoś dla was, słuchacze i słuchaczki. Pani profesor Łobocka specjalizuje się właśnie w bakteriofagach, a pani profesor Aleksandrzak-Piekarczyk w bakteriocynach – tutaj poproszę o opowiedzenie, jak one działają. To ciekawe, ponieważ zostały odkryte w zasadzie w podobnym czasie co antybiotyki. I czemu stosujemy bardziej antybiotyki?
T.A.P.: Wszyscy sobie zadają to pytanie, czemu antybiotyki weszły do powszechnego użycia w medycynie, a bakteriocyny nie. Ale to nie znaczy, że nie weszły one do użycia, ponieważ są wykorzystywane w przemyśle spożywczym, natomiast nie na tak dużą skalę, jak antybiotyki w medycynie, ponieważ w przemyśle spożywczym tak naprawdę na palcach jednej ręki możemy policzyć te bakteriocyny, które są używane. Takim najistotniejszym przedstawicielem tej grupy jest lizyna, która jest używana jako naturalny konserwant. Wszyscy się boimy tych konserwantów oznaczonych symbolem E. Mają one różne działanie, natomiast w tych ilościach, w których są używane w produktach spożywczych, nie powinny stanowić zagrożenia. Poza tym bardzo dobrze zabezpieczają produkty przed zakażeniami bakteryjnymi. Powinniśmy sobie uświadomić, że one muszą być i nie możemy z tym walczyć w imię tego, żeby produkty były jak najbardziej naturalne, nie miały żadnej chemii itd., ponieważ jest to nierealne w dzisiejszych czasach. Chyba wolimy mieć trochę konserwantów w produktach spożywczych, niż rozchorować się z powodu zakażenia bakteryjnego. Mamy coraz większy problem z antybiotykoopornością, więc możemy nie być wyleczeni. Jestem zwolenniczką chemii, czyli tych konserwantów w odpowiednich ilościach, z którymi nasza wątroba sobie dobrze radzi.
K.G.: Oczywiście musi być kontrola tego, jak to jest stosowane w przemyśle, ale akurat w Europie to się dzieje.
T.A.P.: Tak, musi być kontrola, odpowiednie stężenia w produktach, nie może być tego za dużo. Ze wszystkim można przesadzić, dawka robi truciznę. Natomiast nizyna jest bakteriocyną, naturalnym konserwantem, nie chemicznym związkiem. Jest produkowana przez bezpieczne bakterie kwasu mlekowego, Lactococcus lactis.
K.G.: Nie jest chemicznym czy syntetycznym związkiem?
T.A.P.: Syntetycznym, naturalnie produkowanym przez bakterie i wykorzystanym jako konserwant w przemyśle mleczarskim. Jest oznaczony symbolem E234. Nizyna jest produkowana przez bakterie kwasu mlekowego. Bakteriocyny są związkami o działaniu przeciwbakteryjnym, produkowanymi wyłącznie przez bakterie. Bakterie produkują jakieś związki, najczęściej są peptydami, czyli takimi związkami złożonymi z aminokwasów, o niewielkiej masie. Zwykle mają poniżej stu aminokwasów, ale zdarzają się też większe, i są produkowane po to, żeby wyeliminować konkurencję przez bakterie.
K.G.: Czyli takie terytorialne zagrania.
T.A.P.: Tak. W związku z tym mają podobne właściwości do właściwości bakteriofagów i antybiotyków, bo cała grupa służy do tego, żeby wyeliminować bakterie.
K.G.: Czy one są też podobnie specyficzne jak bakteriofagi? Czy można je stosować przeciwko konkretnym bakteriom?
T.A.P.: To jest prawdopodobnie jedna z przyczyn tego, dlaczego bakteriocyny nie weszły do powszechnego użycia w medycynie w czasie ich odkrycia, produkcji, oczyszczania itd. Dlatego, że mają one zwykle wąskie spektrum działania. W dzisiejszych czasach możemy sobie pozwolić, a wręcz jest to korzystne, żebyśmy mieli związki o wąskim spektrum działania, które nie niszczą mikroflory przewodu pokarmowego czy mikrobiomu skóry itd. Natomiast sto lat temu nie wiedzieliśmy, na co działamy, nie było czasu, żeby się zastanawiać, zresztą nie mieliśmy technik, żeby sprawdzić, co spowodowało infekcję, więc podawaliśmy coś, co zabija większość bakterii. I antybiotyki się fantastycznie sprawdzały w tej roli, natomiast w dzisiejszych czasach terapie spersonalizowane są jak najbardziej pożądane. Ze względu na to, żeby oszczędzić nasz mikrobiom jelitowy i na to, że mamy możliwość ich stosowania, możemy w szybki sposób zbadać, co wywołuje choroby, i zaproponować konkretną, spersonalizowaną terapię, np. w postaci fagów, bakteriocyn. Bakteriocyny podobnie jak fagi mają wąskie spektrum działania, często wręcz szczepowo, gatunkowo specyficzne. Ale są też bakteriocyny, które działają na szerokie spektra bakterii. Są nawet takie, które działają na grupy bakterii Gram-dodatnich i Gram-ujemnych. Co prawda jest to bardzo rzadkie, ale są.
K.G.: Czy wyizolowanie tych substancji, które produkują bakterie, bakteriocyny, jest łatwe technicznie? Mamy hodowlę bakterii i łatwo to pobieramy, jak miód z ula?
T.A.P.: Bakteriocyny są dosyć różnorodną grupą. Mamy takie, które są silnie modyfikowane potranslacyjnie, czyli mają dodawane jakieś grupy podczas produkcji, syntezy. Ale są też takie, które są niemodyfikowane, proste, składające się właściwie tylko z aminokwasów i da się je dość łatwo wyprodukować. W ogóle bakteriocyny w przeciwieństwie do antybiotyków są trochę inaczej syntetyzowane, ponieważ antybiotyki są syntetyzowane przez takie skomplikowane maszynerie, nierybosomalnie. Natomiast bakteriocyny są syntetyzowane w rybosomach. Więc mamy znaczną różnicę pomiędzy sposobem syntezy i w związku z tym efektów, które dostajemy. Bakteriocyny często są po prostu taką kupką aminokwasów, bez żadnych dodatków, więc są w miarę prosto produkowane i mogłyby być w miarę prosto uzyskiwane na większą skalę.
K.G.: I podawane w formie tabletek, zastrzyków?
T.A.P.: Ze względu na swoją budowę bakteriocyny raczej mogłyby być stosowane miejscowo, na skórę, np. przy jakichś infekcjach gronkowcowych, wobec których mają bardzo silne działanie. Jednak są też plany, żeby podawać je doustnie, natomiast ze względu na swój białkowy charakter musiałyby być zabezpieczone przed trawieniem przez peptydazy w żołądku. Bo pierwsze trawienie białek mamy w żołądku, później kolejne w dwunastnicy, więc musiałyby być zabezpieczone tak, żeby dotrzeć do swojego celu bez wcześniejszej hydrolizy. Ale mamy metody zabezpieczania związków, żeby dotarły w całości do jelita grubego. Ze względu na to, że bakteriocyny są substancjami białkowymi, są też bezpieczne dla środowiska, bo szybko się w nim rozkładają. Czyli nie prowadziłyby do rozwinięcia mechanizmów oporności, ponieważ są szybko degradowane. To samo, jeżeli chodzi o użycie w przypadku hodowli zwierząt. Do dzisiaj pomimo tego, że nizyna jest wykorzystywana jako konserwant, nie ma opornych na nią bakterii ze względu na to, że jeżeli ten konserwant jest spożywany, to zostaje on rozłożony już w żołądku.
K.G.: Czyli bakteriocyny są stosowane w przemyśle spożywczym i nie są stosowane w medycynie, ale o ile wiem, bakteriofagi są okazjonalnie stosowane w medycynie.
M.Ł.: Problem tych antybiotykoopornych infekcji prowadzących do sepsy, do śmierci w tej chwili narasta i dotyka coraz większych grup osób, również lekarzy. Nawet najwięksi lekarze są po prostu bezsilni. Jeżeli ktoś, kto jest członkiem Amerykańskiej Akademii Nauk, słynnym mikrobiologiem, nie może sobie poradzić z infekcją swojego dziecka antybiotykoopornym szczepem gronkowca – a mieliśmy taką sytuację jakiś czas temu – to sytuacja wymaga działania. W tej chwili mamy dwie grupy krajów – takie kraje jak np. Gruzja, gdzie stosuje się powszechnie terapię fagową, jest tam instytut fagowy w Tbilisi, który powstał właśnie w czasach odkrycia bakteriofagów. Był tam m.in. taki profesor Eliawa, który rozpowszechnił użycie bakteriofagów w czasach, kiedy nawet nie znano dokładnych mechanizmów ich działania.
Z bakteriofagami jest taka sprawa, że my dopiero niedawno, z rozpoczęciem ery masowego sekwencjonowania genomowego, metagenomowego, czyli środowiskowego, zobaczyliśmy, jakie one są, co kodują, mogliśmy je dokładnie poznać. Dopiero w ostatnich latach nastąpił taki rozwój metod biologii molekularnej, mikroskopii fluorescencyjnej, elektronowej, spektrometrii mas umożliwiającej detekcję białek, dopiero teraz uczymy się, jak działają bakteriofagi, czym one są, jakie są reguły ich stosowania. Z bakteriofagami jest jak z grzybami – są bakteriofagi dla nas dobroczynne w tym sensie, że mogą zabijać patogenne bakterie. To są tzw. bakteriofagi bezwzględnie lityczne. Są też bakteriofagi łagodne, które charakteryzują się tym, że mogą w odpowiednich warunkach zainfekować bakterię, rozwijać się w niej litycznie, prowadząc do wytwarzania potomnych bakteriofagów, a w niekorzystnych dla siebie warunkach mogą tę bakterię zainfekować, wprowadzić DNA i to DNA może się wbudować do jej genomu. Bakteriofagi kodują cechy adaptacyjne dla tej bakterii, np. jakieś czynniki wirulencji. Muszę bardzo istotnie podkreślić, że tak jak grzyby pleśniowe różnią się od prawdziwków i od pieczarek, i tak jak muchomor sromotnikowy różni się w działaniu, te bakteriofagi też się różnią w działaniu. Dysponujemy teraz technikami, które w bardzo skuteczny sposób pozwalają nam wybrać wyłącznie te bakteriofagi bezwzględnie lityczne. Co więcej, ostatni rozwój metod inżynierii genetycznej pozwala na zmiany genomu tych bakteriofagów łagodnych w taki sposób, żeby one też były bezwzględnie lityczne. Był taki przykład zastosowania w Stanach Zjednoczonych u dziewczynki z mukowiscydozą, zakażoną mykobakterią smegmatis w stanie zupełnie krytycznym, takich bakteriofagów łagodnych zmienionych tak, żeby były lityczne. I to uratowało tę dziewczynkę. To jest bardzo głośny przypadek, były zaangażowane w jego realizację czołowe amerykańskie instytucje, zarówno szpitale, instytut fagowy w Pittsburghu, jak i Narodowy Instytut Zdrowia. W tej chwili stosowanie fagów terapeutycznych w takich przypadkach to są przykłady współpracy wielu instytucji.
K.G.: A czy może być tak, że terapie bakteriofagami, bakteriocynami w jakimś przewidywanym terminie staną się realną alternatywą, taką na co dzień, u lekarza? Okazuje się, że mamy chorobę bakteryjną i lekarz nam przepisuje nie antybiotyk, tylko preparat z bakteriocyn albo zawierający bakteriofagi.
T.A.P.: Jest to jak najbardziej możliwe. Może niezupełnie alternatywną terapią, ale pomocą dla antybiotyku, łączoną terapią. W przypadku bakteriocyn potrzebujemy porządnych badań klinicznych, żeby móc cokolwiek wyrokować. Nie ma jeszcze wielu tych badań. Jakieś się pojawiają, wiem, że w weterynarii jest jakiś preparat bakteriocynowy, do stosowania miejscowego na skórę przeciwko gronkowcowi i to się dobrze sprawdza. Bakteriocyny mają też ten plus, że nie wywołują odporności krzyżowej z antybiotykami, ponieważ mają zupełnie inne mechanizmy działania. Mają też ten plus – przynajmniej te niemodyfikowane potranslacyjnie bakteriocyny – że mają bardzo bezpieczny profil stosowania, jeżeli chodzi o cytotoksyczność. Nie są tak cytotoksyczne, jak antybiotyki, w związku z czym możemy używać większych stężeń w terapiach przy niższym ryzyku wywołania oporności. Tak jak mówiłyśmy, że dawka uodparnia bakterie, to w przypadku bakteriocyn możemy sobie wyobrazić, że stosujemy ich wysokie stężenia i w związku z tym ta oporność nie narasta. Możemy je stosować razem z antybiotykiem w niższym stężeniu, a wyższe stężenie bakteriocyny. Mamy wtedy dwa mechanizmy działania i taka oporność też gorzej narośnie, ponieważ trudno uzyskać oporność w dwóch miejscach np. w genomie. Mutacje punktowe czy nawet przeniesienie genu zawierającego jakieś funkcje dawania oporności nie są już takie proste. Więc wydaje mi się, że jest to jak najbardziej wskazany kierunek i obecnie również realizowany, ponieważ są badania, projekty, publikacje, które pokazują, że idziemy w tym kierunku. Ale pewnie do takiego momentu, że lekarz przepisuje w przychodni, jeszcze trochę musimy poczekać. Natomiast czas nas nagli i myślę, że to jest w tej chwili największy doping dla zwiększenia badań w tym kierunku, co zresztą się dzieje. Bo jak się porównuje liczbę publikacji dotyczących bakteriocyn czy projektów, które oceniają ich działanie, możliwość ich wdrożenia, to jest tego znacznie więcej, niż było. Rośnie to lawinowo.
K.G.: Zdaje się, że w przypadku bakteriofagów też tak jest. Czy nie było trochę tak, że przedstawiciele zachodniej nauki uznawali z przekąsem, że to radziecka metoda?
M.Ł.: Było tak, ale wynikało to z braku dostatecznej wiedzy o bakteriofagach. Pierwsze publikacje opisujące cały genom pojawiły się na początku tego wieku, krótko po publikacji pierwszej pełnej sekwencji. Były trudności z utrzymaniem sekwencji DNA, ponieważ kiedyś stosowano takie metody, że trzeba było najpierw wprowadzić ją do bakterii w postaci takiej kolistej cząsteczki DNA, tzw. plazmidu i dopiero tego użyć do sekwencjonowania. Tymczasem bakteriofagi obligatoryjnie lityczne kodują bardzo dużo białek, które są toksyczne dla bakterii. W związku z tym nie dało się wprowadzić do bakterii fragmentów DNA kodujących te białka. Jeżeli chodzi o słynny projekt sekwencjonowania genomu bakteriofaga T4, to jest to genom, który ma sto siedemdziesiąt tysięcy par zasad. Dla porównania zwykła Escherichia coli ma cztery i pół miliona. Więc on jest istotnie mniejszy. Niemniej jednak podawano kilka terminów, w których ten projekt miał być opublikowany, a potem jak usiłowano złożyć całość z tych kawałków, to okazywało się, że ciągle nie ma tej całości, bo czegoś brakuje. Dopiero jak weszły nowe metody sekwencjonowania, gdzie można wziąć DNA i zsekwencjonować wszystko w probówce, okazało się, że możemy to sekwencjonować. I dopiero wtedy zostały ujawnione tajniki tych genomów. Okazało się, co one kodują, że te bakteriofagi tzw. bezwzględnie lityczne nie kodują czynników wirulencji, toksyn bakteryjnych. W związku z tym możemy je stosować, ale trzeba jeszcze zwrócić uwagę na inne oblicze stosowania bakteriofagów. Mianowicie bakteriofagi są produkowane w komórkach bakterii. I żeby uzyskać bakteriofaga, który efektywnie infekuje komórki klinicznych izolatów bakterii, musimy użyć bakterii, która jest do nich podobna, żeby on był do nich przystosowany.
K.G.: Czyli musimy używać bakterii chorobotwórczych?
M.Ł.: To nie są bakterie chorobotwórcze sensu stricto, bo przystosowuje się je, pozbawia się je tych czynników w genomie, które powodują chorobotwórczość. Zrobiliśmy m.in. takie szczepy. Pamiętajmy, że bakteriofag, ten surowy preparat to są bakteriofagi namnożone w komórce i to, co się z tej komórki wylało. Oczywiście możemy to w dosyć łatwy sposób oddzielić. Ale np. czasem jest tak, że jeżeli komórka zawiera w genomie wbudowane DNA tych bakteriofagów łagodnych, to one też będą w takim produkcie. Nie da się wtedy tego oczyścić i jedynym rozwiązaniem jest produkcja takich szczepów, które nie mają tych genomów bakteriofagów łagodnych, bo wtedy to, co się wydostaje z tej komórki, to są wyłącznie bakteriofagi terapeutyczne, czyli te bezwzględne.
K.G.: Czytałam, że myślicie przede wszystkim o zastosowaniu na skórze.
M.Ł.: To jest najprostsze. Przy czym tajemnicą Poliszynela jest to, że wiele osób, które były w Gruzji, kupiły sobie tam różne preparaty z bakteriofagami i się nimi zupełnie świadomie polewały, i uzyskały bardzo pozytywne rezultaty. Gronkowiec bardzo często powoduje wiele zakażeń skórnych, np. liszajec zakaźny. Jest to paskudna choroba skóry, która występuje najczęściej u niemowląt i dzieci do sześciu lat, bardzo często przez gronkowca złocistego lub paciorkowce. Tzw. Cutibacterium acnes występuje w wielu chorobach, np. zakażeniu trądzikowym, ale często również w towarzystwie gronkowca złocistego. Przy czym wiadomo, że to jest szczególną bolączką młodych ludzi, którzy mają zwiększoną ilość wydzieliny na skórze. Promuje to oczywiście rozwój bakterii, więc bez żadnych zahamowań można by stosować i stosuje się w wielu krajach właśnie preparaty bakteriofagów i bakteriocyn.
K.G.: Czy to jest tak, że mogą panie w laboratorium przygotować takie preparaty niemalże pod każdą bakterię, pod tę wspomnianą Acinetobacter, która jest tak groźna w szpitalach?
M.Ł.: Prowadzimy np. badania nad bakteriofagami gronkowcowymi, ale również we współpracy z Instytutem Immunologii i Terapii Doświadczalnej PAN, który prowadzi eksperymentalne terapie fagowe, prowadziliśmy badania nad fagami Klebsiella, Pseudomonas i Enterococcus. We współpracy z Wojskowym Instytutem Higieny i Epidemiologii uczestniczyliśmy również w analizach genomów tych bakteriofagów Acinetobacter baumannii. Jest kilka ośrodków w Polsce, które się specjalizują w badaniach różnych bakteriofagów. Na Uniwersytecie w Szczecinie pan doktor Bartłomiej Grygorcewicz bada bakteriofagi Acinetobacter. W tym momencie możemy stworzyć właściwie taki ciąg produkcyjny. Izolacja bakteriofagów, badania ich, ale takie badania, które nie wymagają aż dwudziestu lat, bo są stosunkowo szybkie do przeprowadzenia. Musimy mieć dostęp do klinicznych kolekcji szczepów bakteryjnych. Interesują nas te bakteriofagi, które będą zabijały specyficznie te szczepy.
K.G.: Jest jedna zasadnicza wątpliwość – praktyka. Skoro będą tworzone bardzo specyficzne preparaty pod specyficzne bakterie, to jak bardzo realna jest w powszechnej medycynie możliwość sprawdzenia, z jaką bakterią mamy do czynienia? Czy nie rozbije się to w pewnym momencie o koszty?
M.Ł.: Trzeba powiedzieć, że koszty terapii są zwykle wyższe niż koszty diagnostyki.
T.A.P.: Ale w tej chwili diagnostyka nie jest taka droga. Są jakieś minutowe testy, które można wykonać. Często też lekarz jest w stanie sam rozpoznać po objawach, co jest powodem infekcji. Poza tym jeżeli chodziłoby już o leczenie chorób, które zagrażają życiu, to koszty nie są tak naprawdę istotne. To jest jak najbardziej do realizacji, niezależnie od kosztów. Nawet jeżeli te koszty by były trochę wyższe, to myślę, że w sytuacjach ratujących życie, gdzie antybiotyk już nie pomaga, jest np. sepsa…
K.G.: Czyli jednak bardziej szpitalne sytuacje niż w gabinetach?
T.A.P.: W gabinetach też, natomiast zależy, którą drogą byśmy chcieli iść – czy w przypadku ratowania życia, czy do pomocy dla antybiotyków w ramach jakichś infekcji skórnych.
M.Ł.: Ale jest w tej chwili nowa koncepcja propagowana przez firmę Intralytix, która już dwadzieścia lat temu zapoczątkowała badania nad zwalczaniem salmonellozy u kurcząt przy pomocy bakteriofagów. Obecnie coraz bardziej zbliżamy się do takiego bardzo naturalnego poglądu, że bakteriofagi są częścią normalnego środowiska. Towarzyszyły nam od wieków, jest ich bardzo dużo, pijemy je z wodą, jemy. Są bakteriofagi przeciwko bakterii Listeria, które zostały oficjalnie dopuszczone jako dodatki do gotowych do spożycia produktów mlecznych i serowarskich. Znajdują się one np. w serach belgijskich czy holenderskich. Uzyskały status GRAS, chronią przed zakażeniem tych produktów Listerią.
K.G.: Czyli są to w pewnym sensie konserwanty.
M.Ł.: W pewnym sensie. Listeria monocytogenes to bakteria, która bardzo często jest źródłem zakażenia pochodzącym z produktów mięsnych, z serów, i jest śmiertelnie niebezpieczna. Takie zakażenia zdarzają się nawet teraz. Zabezpieczenie produktów, które mogą ją zawierać, żywymi bakteriofagami, powoduje, że tych żywych bakterii nie ma.
K.G.: One nie są wrażliwe na temperaturę?
M.Ł.: Bakteriofagi są niesamowicie różnorodne. Możemy wybrać spośród licznych izolatów takie, które są mniej lub bardziej wrażliwe. Oczywiście, jest wiele badań pokazujących, jakie warunki sterylizacji czy pasteryzacji, które zabijają bakterie, będą chroniły niektóre bakteriofagi. Takie badania prowadzi się np. w przemyśle spożywczym dlatego, że wiele produktów spożywczych jest zakażanych przez bakterie. Powoduje to olbrzymie straty, bo te produkty się psują, kwaśnieją, stają się smakowo paskudne. W interesie producentów jest to, żeby zapobiegać rozwojowi takich bakterii. Jeżeli się doda do tego bakteriofagi i dopasuje się warunki pasteryzacji czy sterylizacji tak, że dany bakteriofag będzie przeżywał, to oczywiście mamy olbrzymi korzystny efekt finansowy.
T.A.P.: W przypadku bakteriocyn czy w ogóle konserwacji produktów spożywczych bardzo ciekawe jest to, że wykorzystujemy do produkcji produktów fermentowanych bakterie kwasu mlekowego, w tym również bakterie probiotyczne o korzystnym wpływie na człowieka. I one naturalnie produkują bakteriocyny. Czyli to, że produkt fermentowany jest bezpieczny i naturalnie zabezpieczony, to jest m.in. kwestia tego, że są tam obecne bakteriocyny. Przyjmuje się, że większość bakterii potrafi je produkować. Są to bakterie kwasu mlekowego, najczęściej zdrowe, bezpieczne. W związku z tym bakteriocyny też są dla nas korzystne. Więc te produkty mleczarskie, fermentowane warzywne, mięsne są zabezpieczane z wykorzystaniem bakteriocyn produkowanych naturalnie przez bakterie, które uczestniczą w procesach fermentacji.
K.G.: Czyli te rozwiązania, o których opowiadamy, są wśród nas, tylko trzeba je…
T.A.P.: Wykorzystać – co zresztą robimy, bo zajmujemy się głównie bakteriocynami produkowanymi przez bakterie kwasu mlekowego, czyli Lactococcus lactis, Lactobacillus. Nizyna ma również fantastyczne działanie, które polega głównie na tym, że zabezpiecza te produkty mleczarskie przed Listerią, która jest bardzo dużym zagrożeniem.
K.G.: Mają panie poczucie, że uczestniczą w takim wyścigu, o którym się będzie kiedyś opowiadało w podręcznikach historii?
T.A.P.: Myślę, że już się opowiada i jest bardzo duży wyścig, ponieważ zaczynamy coś robić, jesteśmy w trakcie, poszukujemy czegoś w internecie, w publikacjach i okazuje się, że zostało to już zrobione. Wszyscy się spieszą. Z jednej strony jest to bardzo dobre, że tyle osób się tym zajmuje i jest taka pogoń, bo konkurencja też napędza nas do rozwoju, szukania nowych pomysłów i rozszerzania tych badań. Natomiast jest w tej chwili duży wyścig, to widać.
M.Ł.: Przede wszystkim narastają potrzeby ze względu na oporność na antybiotyki. W tej chwili np. Australia jest przodującym krajem w rozwoju terapii fagowej. Co więcej, wiele krajów europejskich wprowadziło tzw. zasadę magistral phage therapy – jest tak np. w Niemczech, Belgii, Holandii, Francji. Dobiera się preparat różnych bakteriofagów do szczepu obecnego u pacjenta i podaje się mu ten preparat. Jest to dobry kierunek, bo zmierzamy ku tzw. spersonalizowanej terapii fagowej. Jeżeli się przyjrzymy temu, co się dzieje, to mamy dosyć szybkie badania podstawowe, przy czym np. w Niemczech wprowadzono w diagnostyce bakterii spektrometrię mas, która polega na tym, że na podstawie białek, które można szybko zidentyfikować, określa się, jaki gatunek bakterii jest sprawcą infekcji. To są już szybkie, masowe techniki, które wchodzą do użytku. Przecież nawet jeżeli spojrzymy na to, co się dzieje u nas w poradniach, to kiedyś każda poradnia miała swoje laboratorium, gdzie pani pracowicie badała krew. W tej chwili to się zbiera, wiezie do centralnego laboratorium, gdzie maszynowo są robione testy. Być może kiedyś będziemy po prostu wkładali naszą próbkę krwi do jakiegoś małego urządzenia, które będzie miało wszystko zautomatyzowane i będzie nam wypluwało wynik w postaci wydruku czy pliku PDF. Rozwój cywilizacji idzie właśnie w tym kierunku – zminiaturyzowania wszelkich tego typu testów, zwiększenia ich skuteczności, dokładności i przyspieszenia. W momencie, kiedy mamy w ręku coraz lepsze metody diagnostyczne, mamy również możliwość coraz lepszego dopasowania terapii do konkretnych potrzeb.
K.G.: A czy panie jako naukowczynie mają też kontakt z pacjentami? Czujecie tę presję, że trzeba się spieszyć?
T.A.P.: Mamy kontakt w postaci projektów realizowanych wspólnie np. ze szpitalami. Natomiast nie jest to bezpośredni kontakt, nie mamy uprawnień, żeby przyjmować pacjentów. Ale dostajemy próbki, informacje, często anonimizowane, bo w tej chwili jest to bardzo istotne. Widzimy, co się dzieje. W naszym instytucie nie tylko my się zajmujemy problemem antybiotykooporności, są jeszcze inne grupy badawcze, które też widzą zagrożenie i zajmują się kontrolą i publikowaniem danych odnośnie do rozprzestrzeniania się tych genów oporności na różne antybiotyki. Tak że jesteśmy na bieżąco.
K.G.: Są też schorzenia męczące i przewlekłe, nie tylko takie gwałtowne jak sepsa.
M.Ł.: Zdecydowanie. Jeżeli chodzi o zakażenia gronkowcem, to jest ich bardzo dużo. Przy czym ludzie często chodzą od lekarza do lekarza, stosują różne antybiotyki, maści, domowe sposoby i to często zawodzi. Natomiast szczególnie w przypadku tych zakażeń zewnętrznych bakteriofagi są niezwykle skuteczne. Mieliśmy do czynienia z przykładem kupionych preparatów w Gruzji, które ktoś zastosował u jakiejś swojej bliskiej osoby, i okazało się, że dwuletnie leczenie w różnych gabinetach lekarskich nie dało rezultatu, a zadziałało polanie się kilka razy tym preparatem.
K.G.: Czy może to przynieść skutki uboczne? Wyobrażam sobie teraz, że część naszych słuchaczy myśli sobie: no to zamawiam z tej Gruzji. Czy to na pewno jest dobry pomysł – robić to tak bez kontroli?
M.Ł.: Myślę, że jeżeli chodzi o zakażenia zewnętrzne, to ja bym bez problemu to na sobie zastosowała. Uważam, że w przypadku oczyszczonych bakteriofagów głównym mankamentem preparatów gruzińskich jest to, że są one produkowane na bakteriach, które w części nie są oczyszczone z tych elementów niepożądanych w ich genomach. Natomiast to, co robimy w tej chwili, to są absolutnie dobre szczepy do produkcji bakteriofagów. Nie ma tego niebezpieczeństwa w ogóle. Więc to, co mamy w tym preparacie, to wyłącznie bakteriofag terapeutyczny. Przy czym mamy mieszankę dwóch różnych bakteriofagów, które są zupełnie różne taksonomicznie, i wykazaliśmy w badaniach, że jeżeli się pojawi oporność na jednego, to te bakterie nadal są wrażliwe na drugiego. Ale co istotne, bakteriofagi infekują bakterie zarówno oporne na antybiotyki, jak i wrażliwe.
K.G.: To skoro badania są już przynajmniej w pewnych obszarach tak zaawansowane, to co się robi dalej? Trzeba się dogadać z jakąś firmą farmaceutyczną, żeby to przyjęła, czy robi się to na poziomie instytutu?
T.A.P.: Pewnie żeby było to stosowane jako lek i mogło być sprzedawane, musiałoby mieć całe portfolio takich badań, czyli testów przedklinicznych i klinicznych.
M.Ł.: Mogę powiedzieć, że jesteśmy na drodze do realizacji tych celów. Epidemia COVID-u spowodowała niestety dosyć dużą przerwę z tym związaną, chociaż trzeba wspomnieć, że sporo zgonów COVID-owych to były zgony spowodowane również zakażeniem gronkowcem złocistym Pseudomonas. Ludzie ciężko chorzy stawali się wrotami infekcji dla bakterii patogennych. Jest chyba nawet jakaś praca o zastosowaniu bakteriofagów w aerozolach dla takich pacjentów. Uważam, że jesteśmy na dobrej drodze. Staramy się szerzyć wiedzę na temat bezpieczeństwa bakteriofagów fagowych z molekularnego punktu widzenia. Przy czym, jeżeli chodzi o produkcję, to jeśli bakteriofagi są teraz używane w tych eksperymentach medycznych, to to, co jest wprowadzane do takich badań w Instytucie Immunologii i Terapii Doświadczalnej PAN, to wykorzystanie naszych szczepów, żeby te bakteriofagi były bezpieczne. Poza tym same preparaty muszą być produkowane w procedurze GLP i GMP. Są to standardy do produkcji różnych preparatów. Musi być określone miano, czyli ile takiego bakteriofaga tam jest. Na szczęście te nasze bakteriofagi są stabilne, w sensie, że jeżeli są w płynie, w jakichś aerozolach, to pracuje się nad tym, żeby zrobić tabletki. Trzeba przyznać, że Czesi są przed nami, jeżeli chodzi o badania i produkcję tych preparatów, bo tam już jest firma, która produkuje tabletki zawierające bakteriofagi przeciwko Pseudomonas i gronkowcowi złocistemu. Muszę też powiedzieć, że z naszych badań wynika, że najlepsze spektrum działania mają bakteriofagi uzyskane w danym czasie, lokalnie dlatego, że wygląda na to, że one są najlepiej przystosowane do tych aktualnie infekujących szczepów. Te nasze bakteriofagi były izolowane w latach dwa tysiące dwanaście, dwa tysiące czternaście. Radzą sobie one nieco lepiej niż te historyczne.
K.G.: Zmienność w tym świecie jest tak szybka, ewolucja jest wszędzie widoczna. Bardzo serdecznie paniom kibicuję i dziękuję za obecność w studio Radia Naukowego. Pani profesor Małgorzata Łobocka – dziękuję bardzo.
M.Ł.: Dziękuję serdecznie.
K.G.: Pani profesor Tamara Aleksandrzak-Piekarczyk – dziękuję bardzo.
T.A.P.: Dziękuję bardzo.
K.G.: Instytut Biochemii i Biofizyki Polskiej Akademii Nauk.
Źródła statystyk:
Raport Europejskiego Centrum ds. Zapobiegania i Kontroli Chorób
Strona pacjent.gov.pl
Wizualizacja ataku bakteriofagów

Kieruje Pracownią Biologii Bakteriofagów w Instytucie Biochemii i Biofizyki Polskiej Akademii Nauk. Zajmuje się biologią bakteriofagów, w szczególności ich strategiami przetrwania i unikania mechanizmów obronnych bakterii.

Kieruje Pracownią Mikrobiologii Stosowanej w Instytucie Biochemii i Biofizyki Polskiej Akademii Nauk. Jej zainteresowania badawcze to przede wszystkim molekularne mechanizmy bioaktywności bakterii kwasu mlekowego, w tym mechanizmy produkcji bakteriocyn.