
Laureat ERC Starting Grant, prestiżowego grantu przyznawanego przez Europejską Radę ds. Badań Naukowych projektom o pionierskim charakterze, przekraczającym obecne granice wiedzy. Pracuje w Instytucie Mikromechaniki i Fotoniki na Wydziale Mechatroniki Politechniki Warszawskiej. Zainteresowania naukowe: mikroskopia obliczeniowa, obrazowanie komórek i tkanek, interferometria, przetwarzanie i analiza danych, cyfrowa mikroskopia holograficzna, biofotonika, algorytmy numerycznej rekonstrukcji, ilościowe obrazowanie fazy, mikroskopia bez znaczników.
Kieruje Quantitative Computational Imaging Lab
Wyobraźcie sobie badanie komórek pod mikroskopem: szukacie konkretnego zjawiska, macie do dyspozycji dziesiątki tysięcy wyhodowanych komórek, ale żeby coś zobaczyć, trzeba je oczywiście odpowiednio powiększyć. Pole widoczne w odpowiednio mocnym mikroskopie mierzy zaledwie 80×80 mikrometrów, a więc mieści się w nim dosłownie kilka komórek. – Trzeba mieć dużo szczęścia, żeby trafić akurat na takie komórki, które zachowują się w sposób ciekawy dla nas – mówi prof. Maciej Trusiak z Instytutu Mikromechaniki i Fotoniki na Wydziale Mechatroniki Politechniki Warszawskiej, laureat ERC Starting Grant, czyli prestiżowego europejskiego „grantu na przełom” – służy poszukiwaniu nowych rozwiązań i pól nauki. Prof. Trusiak otrzymał taki właśnie grant na projekt NaNoLens: nanoskopii bezsoczewkowej i bezznacznikowej. Nowe narzędzie badawcze ma pozwolić na o wiele szersze pole widzenia i obserwację wielu komórek jednocześnie.
NaNoLens ma odpowiedzieć na jeszcze jeden problem. Żywe komórki są przezroczyste. Żeby móc im się przyglądać, korzysta się z mikroskopii fluorescencyjnej: przed pomiarem wybarwia się próbkę (można nawet osobno wybarwić poszczególne elementy komórki), następnie mocno się ją naświetla, by wzbudzić fluorofory, które zaczynają świecić na dany kolor, i pod mikroskopem wszystko pięknie widać. Ten system ma jednak poważne wady: zajmuje dużo czasu, jest dość kosztowny i obciąża komórkę – nie do końca wiemy, czy bez kolorowania i naświetlania zachowywałaby się tak samo.
Projekt NaNoLens zakłada rezygnację ze znaczników. Ale jak coś bez nich zobaczyć? Potrzebne są światło i… algorytm. – Mikroskopia obliczeniowa składa się z dwóch etapów: najpierw rejestrujemy dane, potem je rekonstruujemy – opowiada prof. Trusiak. Przez badaną komórkę przepuszczamy światło, nagrywamy efekt, a potem odpowiedni algorytm dokonuje wstecznych obliczeń, jak musiała wyglądać komórka w tym procesie. Dzięki zastosowaniu techniki bezsoczewkowej można natomiast obserwować całą kolonię komórek naraz, a więc wyłapać interesujące nas zjawisko dużo szybciej i z mniejszą szansą, że coś przeoczymy lub pomylimy. Fascynujące, co?
Rozmawiamy też o tym, do czego można byłoby wykorzystywać w przyszłości technologię NaNoLens, co trzeba zrobić, żeby dostać grant ERC, jak ważne są pieniądze w nauce (bardzo!) i w jakich dziedzinach „Polak potrafi” w światowej nauce (jesteśmy mocni w fotonice i optyce). Bardzo polecam ten odcinek, to konkretne zajrzenie za kulisy nauki!
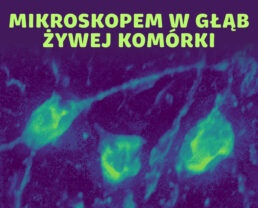
Na filmie widać obraz 3D neuronów. Autorami wideo są dr Piotr Zdankowski, dr Julianna Winnik z Grupy Ilościowego Obrazowania Obliczeniowego na Politechnice Warszawskiej, laboratorium kieruje prof. Maciej Trusiak. Zobrazowany materiał (neurony) przygotowała dr hab. Marzena Stefaniuk z Instytutu Biologii Doświadczalnej PAN.
TRANSKRYPCJA
Karolina Głowacka: Doktor habilitowany inżynier Maciej Trusiak, profesor Politechniki Warszawskiej znalazł czas dla Radia Naukowego. Dzień dobry.
Maciej Trusiak: Dzień dobry.
K.G.: Z Instytutu Mikromechaniki i Fotoniki, Wydział Mechatroniki wspomnianej uczelni. Profesor Trusiak jest laureatem prestiżowego grantu ERC Starting, a granty ERC przyznawane przez Europejską Radę ds. Badań Naukowych to jest duża rzecz. To jest już takie bycie wschodzącą gwiazdą w Polsce.
M.T.: Nie wiem, czy gwiazdą, ale rzeczywiście sito selekcyjne jest bardzo gęste. Ale udało się i jestem z tego bardzo zadowolony.
K.G.: Gratulacje. Projekt, nad którym wraz z zespołem pracujesz w ramach grantu to NaNoLens – co to takiego?
M.T.: NaNoLens to jest mikroskopia bezsoczewkowa i bezznacznikowa. Pewnie potem będziemy mogli porozmawiać o tych słowach dłużej. Bez znaczników, bez soczewek i wysoka rozdzielczość, czyli podglądamy ten świat z bardzo dobrą rozdzielczością.
K.G.: Jak rozumiem, chodzi o to, żeby przenieść na nowy poziom możliwości obserwacji życia, przede wszystkim żywych komórek.
M.T.: Tak, obserwujemy żywe komórki. Główny cel jest taki, żeby obserwować je wszystkie, a nie tylko wybrane komórki i żeby robić to bardzo dokładnie, żeby żaden szczegół nam nie umknął.
K.G.: Zanim dokładnie będę cię wypytywać o to, co projekt NaNoLens ma wprowadzić nowego, jeśli chodzi o możliwości podglądania życia na żywo, tych żywych komórek. Ustalmy, jakie metody są teraz, bo one i tak już są imponujące. I zresztą całkiem świeże, bo zdaje się, że w okolicach dwutysięcznego roku pojawiły się te wtedy przełomowe możliwości. A piję do mikroskopii fluorescencyjnej – na czym to polega?
M.T.: Mikroskopia fluorescencyjna polega na tym, że przeprowadzamy przed pomiarem barwienie fluorescencyjne. Robimy to po to, żeby nasza komórka sama świeciła. Takie barwienie otwiera duże możliwości, bo możemy np. kolorem czerwonym wybarwić jedną organellę, np. jądro komórkowe, a kolorem zielonym mitochondria. Mamy wtedy tzw. specyficzność obrazowania. Samo obrazowanie polega na tym, że dokonujemy wzbudzenia tych fluoroforów, które wcześniej przyczepiliśmy do odpowiednich struktur komórki czy naszej próbki i które później świecą. Taki proces jest bardzo dobry, ale musimy poświęcić na niego czas, pieniądze. Ale mamy kontrast i tę specyficzność. Sama próbka nam świeci. Jak to można porównać do czegoś z życia codziennego? Mógłbym porównać to do choinki, która przed barwieniem jest zwykłą jodełką, która sobie rośnie, i jak jest ciemno, to nie świeci i jej nie widać, a jeżeli ją ubierzemy, założymy lampki, to widać ją w ciemności. Więc fluorescencyjne barwienie porównałbym do takiego ubierania choinki. Pytanie brzmi – czy będąc taką choinką, cieszymy się bardziej, jak jesteśmy wśród innych choinek w lesie, czy jednak jak stoimy w domu i jesteśmy ubrani? Łączy się to z jakimś rodzajem stresu. Ten stres nazywa się stresem fotochemicznym. Komórka wybarwiona nie jest naturalną komórką, jest taką ubraną choinką. Możemy ją lepiej podglądać, ale jednak troszeczkę ją stresujemy. I żeby ją podglądać, bardzo ważne jest to, że najpierw musimy ją dosyć mocno oświetlić, żeby te fluorofory najpierw zaabsorbowały energię i potem ją oddały troszeczkę dłuższą długością fali, ta energia po prostu spada.
K.G.: Czyli trzeba poświęcić dużo i czasu, i energii, i naprawdę dość solidnie zmęczyć tę komórkę, zanim będziemy mogli ją oglądać, więc nie wiemy, jak ona by się zachowywała bez tych wszystkich zabiegów.
M.T.: Dokładnie. Są badania, które dotyczą nie barwienia fluorescencyjnego, ale utrwalania komórek, co się stosuje, żeby wykonać preparaty i potem je obrazować różnymi mikroskopami. Widać, że już sam proces utrwalenia wpływa na strukturę komórki. Sam proces barwienia także. Jak z tą choinką.
K.G.: Bo o tym raczej większość z nas pewnie nie pamięta, ale głównym problemem z podglądaniem żywych komórek jest to, że one najczęściej są po prostu przezroczyste.
M.T.: Tak, to prawda. Więc jeżeli mamy do czynienia z mikroskopem, gdzie wsadzamy oko albo jest po prostu kamera na końcu, to na tej kamerze nic nie widać, bo i kamera, i nasze oko są wyczulone na amplitudę światła. Światło jest falą i ma amplitudę, czyli zakres, w którym ta fala się zmienia. Ta amplituda jest wyższa wtedy, kiedy widzimy więcej światła i niższa, kiedy widzimy go mniej. Jeżeli komórki są przezroczyste, to amplituda się w zasadzie nie zmienia, mało jest tej absorpcji. Więc nie mamy kontrastu, nie widzimy tej komórki albo widzimy ją w sposób niewystarczający do obrazowania. Zatem albo decydujemy się na barwienie fluorescencyjne, albo korzystamy z metod bezznacznikowych.
K.G.: W dwa tysiące czternastym roku trójka naukowców – Eric Betzig, Stefan W. Hell oraz William E. Moerner – otrzymała Nagrodę Nobla z chemii za mikroskopię fluorescencyjną. Czy raczej można by powiedzieć – nanoskopię fluorescencyjną, bo jak Komitet Noblowski podkreślał, przenieśli oni mikroskopię optyczną do nanowymiarów. I to jest coś, czego się używa teraz, jest to bardzo ważne. Ale odkładamy to teraz na bok, żeby zrozumieć dokładniej to, czym ty się zajmujesz, bo to nie jest obserwowanie bezpośrednie. To jest, jak to nazywasz, mikroskopia czy nanoskopia obliczeniowa.
M.T.: Mikroskopia obliczeniowa składa się z dwóch etapów. Najpierw te dane rejestrujemy, a potem rekonstruujemy. W przypadku mikroskopii fluorescencyjnej obrazujemy. Układ optyczny, czyli mikroskop, ma za zadanie przenieść płaszczyznę, która znajduje się w komórce, w naszej próbce, na naszą kamerę i powiększyć. Jeżeli mamy do czynienia z mikroskopią obliczeniową, to najpierw dane rejestrujemy, a potem je rekonstruujemy i ten drugi krok rekonstrukcji ma pomóc pokonać ograniczenia. Jednym z tych ograniczeń jest kontrast, o którym już rozmawialiśmy, ale jest też wiele innych ograniczeń, np. głębia obrazowania. Generalnie cele obrazowania są uniwersalne. Chcemy obrazować więcej, szybciej, lepiej, skuteczniej, taniej. I stąd właśnie rozwój metod obliczeniowych. Takim przykładem z życia codziennego obrazowania obliczeniowego jest tomografia komputerowa. Ten tomograf rejestruje serie, sekwencje danych dwuwymiarowych, które potem algorytm tomograficzny zmienia na wynik, który interpretuje radiolog i który jest już obrazowaniem 3D. Widzimy w trójwymiarze, bo świat się dzieje w trójwymiarze, więc obrazowanie trójwymiarowe jest bardzo ważne. I zajmujemy się mikroskopią obliczeniową po to, żeby pokonać tę barierę kontrastu, czyli żeby przejść z dziedziny amplitudy, gdzie nic nie widzimy, bo nasza komórka jest przezroczysta, nie zmienia ilości światła, które przechodzi. Przechodzimy do dziedziny kontrastu fazowego. Traktujemy promieniowanie jako falę i ta fala to taki wąż, który sobie leci, ma górki, dołki. I okazuje się, że próbka może wpływać na to, w jaki sposób fala podróżuje. W największym skrócie spowalnia tę falę w porównaniu do tego, jak szybko by podróżowała w próżni. Taką wielkością fizyczną, która określa to spowolnienie, jest współczynnik załamania. Okazuje się, że ten rozkład współczynnika załamania jest specyficzny dla danych próbek, bo jądro komórkowe ma wyższy współczynnik załamania, bo jest gęstsze. Jest ciągle przezroczyste, ale gęstsze, więc to światło się tam wolniej propaguje. Okazuje się, że mikroskop obliczeniowy, rejestrując dane, a potem je rekonstruując, korzystając z holografii cyfrowej, o czym pewnie zaraz będziemy rozmawiać, jesteśmy w stanie bardzo precyzyjnie wyznaczyć zmianę współczynnika załamania, czyli zmianę tej fazy.
K.G.: I to jest ta wasza dana, którą potem jakby tłumaczycie z powrotem na obraz?
M.T.: Dane, które rejestrujemy, pochodzą od tego, że dwie wiązki ze sobą interferują. Jedna wiązka, fala optyczna przechodzi przez próbkę i ma zakodowany ten sposób, w który spowalnia ją próbka, a druga nie przechodzi przez próbkę w takim klasycznym podejściu. Potem dokonujemy nałożenia w przestrzeni i w czasie tych dwóch wiązek, i rejestrujemy hologram. Hologram to nic innego jak taka interferencja dwóch fal. Pojawiają się prążki interferencyjne. Można je sobie skojarzyć tak, że np. jak mamy żaluzje w domu i świeci na nie światło słoneczne, to rzucają one cień. I jeżeli ten cień pada na przezroczysty obiekt w naszej kuchni, to te prążki będą się uginać tak, jaki kształt ma ta przezroczysta powierzchnia, na którą pada cień. Albo jak np. jesteśmy na wakacjach, leżymy sobie na leżaczku, który jest utkany z takiego wzoru w kratkę – jak słońce pada na tę kratkę, to ta kratka jest projektowana jako cień na powierzchni piasku i możemy zobaczyć, że te wzory się uginają tak, jak ten piasek jest lokalnie ułożony. Więc dokonujemy rejestracji tego hologramu i potem musimy go zrekonstruować.
K.G.: To jak to wygląda technicznie? To jest tak, że macie źródło światła, dalej jest nasza próbka, przepuszczacie światło przez próbkę, żeby sprawdzić zmianę tej fazy, i macie światło, które nie przechodzi przez próbkę, które jest wam potrzebne do porównania, co się zmieniło?
M.T.: Tak, to jest tzw. wiązka referencyjna. I takie układy są też komercyjnie dostępne. One wykorzystują obiektyw – ja nie zamierzam z niego korzystać – i tę wiązkę referencyjną, która podróżuje innym torem, najczęściej w takim układzie interferometru Macha-Zehndera. Dokładnie jest tak: wydzielamy dwie wiązki, jedna z nich przechodzi przez próbkę, druga nie. To zmniejsza stabilność układu, zwiększa jego wymiary. Tylko my wykorzystujemy mikroskopię bezsoczewkową. I oprócz tego, że nie ma tam soczewek, to jest tylko jedna wiązka źródła światła. Potem jest próbka i za nią jest kamera. Jak ta wiązka światła trafia na próbkę, to bardzo ważne, żeby ta próbka tylko troszeczkę ją modyfikowała. Czyli była lekko rozpraszająca. Bo jak za bardzo rozproszy tę próbkę, to dostajemy tzw. kaszkę i nic tam nie widać. A jeżeli wyobrazimy sobie, że tylko troszeczkę zostaje zmodyfikowana część tej wiązki, a reszta przechodzi niezmodyfikowana, to mamy z jednej wiązki dwie. Jedna rozproszyła się na próbce, więc ma o niej informację, a druga przeszła przez nią nierozproszona, więc jest tą wiązką referencyjną. I teraz nasza kamera czeka na te dwie wiązki, które już są za próbką. Na kamerze rejestrowany jest wynik interferencji, czyli po prostu połączenia ze sobą w czasie i przestrzeni tych dwóch wiązek, czyli hologram. Rejestrujemy hologram na kamerze, więc nie jest możliwe, żebyśmy widzieli ostro odwzorowany obiekt, bo jesteśmy troszeczkę oddaleni od swojej próbki. I tutaj zaczyna się cała magia mikroskopii obliczeniowej, bo jesteśmy w stanie akurat w tym wypadku bardzo dobrze naśladować naturę i wiemy, jak promieniowanie się rozchodzi w wolnej przestrzeni. Jeżeli zarejestrowaliśmy hologram na kamerze, to algorytmy numeryczne odpowiadają za to, żeby przepropagować wstecznie. Czyli, żeby jakby przenieść pole optyczne z płaszczyzny kamery do płaszczyzny próbki.
K.G.: Czyli po prostu policzyć, jak to wyglądało, kiedy przechodziło przez próbkę. Możemy się w ten sposób zbliżyć cyfrowo.
M.T.: Dokładnie. Jakby cofnąć się w czasie i przestrzeni z wykorzystaniem algorytmów numerycznych. To jest jeden z aspektów całej mikroskopii obliczeniowej, którą wykorzystujemy, ale w zasadzie jedną linijką kodu w języku programowania MATLAB można to wykorzystać. Umiemy naśladować, jak fale płaskie, czyli takie najprostsze fale, które się rozchodzą, propagują. Zakładamy, że nasza próbka składa się z jakiegoś zbioru tych fal płaskich i każdą tę falę propagujemy oddzielnie. Może nie będziemy się w to zagłębiać, ale to jest tzw. obrazowanie in silico, tak że na komputerze. Bez algorytmu numerycznego nie zobaczymy naszej próbki. Stąd to obrazowanie obliczeniowe, czyli po prostu przenosimy się z płaszczyzny kamery i propagujemy się wstecz do płaszczyzny próbki. Oczywiście musimy wiedzieć, gdzie jest ta próbka, więc mamy różne algorytmy, które nam pomagają znaleźć odpowiednią płaszczyznę, a potem zwiększyć stosunek sygnału do szumu takiej rekonstrukcji.
K.G.: Jeszcze kwestia tej wspomnianej fazy – to jest coś, co zupełnie naturalnie na co dzień widujemy, np. jak wsadzimy łyżeczkę do wody.
M.T.: Tak. Różnica fazy może wynikać z różnicy współczynnika załamania. Woda ma wyższy współczynnik załamania niż powietrze. Mówi się, że powietrze ma około jeden, woda ma jeden trzydzieści trzy. Jeżeli wsadzimy łyżkę do szklanki, która jest troszeczkę wypełniona wodą, to widzimy, że na granicy tych ośrodków jest różnica tego załamania światła. Światło się bardziej załamuje w ośrodku, w którym jest woda, mniej załamuje w ośrodku, w którym jest powietrze, i przez to ta nasza łyżka wydaje się przesunięta, jak wpada do wody, a nie jest przesunięta, bo wiemy, że ją wsadzaliśmy i widzimy, że nie straciła swojej ciągłości.
K.G.: Dobra, czyli taka mikroskopia obliczeniowa już od jakiegoś czasu funkcjonuje. Ta holografia cyfrowa funkcjonuje. To na czym ma polegać to pójście do przodu w twoim projekcie? Co się ma wydarzyć? Jakie granice chcesz pokonać?
M.T.: Chcielibyśmy pokonać granice rozdzielczości. Rozdzielczość intuicyjnie mówi nam o tym, jak dużo szczegółów możemy zaobserwować. Więc chcielibyśmy pokonać taką barierę rozdzielczości i zaoferować obrazowanie 3D w pełni, rekonstrukcję tomograficzną trójwymiarową, jak tej naszej głowy w tomografie komputerowym, tylko zrobić rekonstrukcję pełnej kolonii komórkowej. Dlaczego nie korzystamy z obiektywów, chociaż są one cudowne, bardzo drogie i bardzo dobrze obrazują informację, która znajduje się w próbce na naszą kamerę? Z jednej głównej przyczyny – żeby coś powiększyć, w naturalny sposób ograniczamy pole widzenia. Czyli możemy widzieć coś powiększone, ale zobaczymy mniej tego wszystkiego, niż przygotowaliśmy. Jeżeli nie wykorzystamy obiektywu, mamy jeszcze drugą zaletę. Oprócz większego pola widzenia mamy też większą głębię ostrości. Okazuje się, że im lepiej chcemy widzieć, im więcej szczegółów chcemy zobrazować, tym mamy mniejszą objętość w próbce, którą możemy zobrazować w ostrości. A jeżeli korzystamy z technik holograficznych, to nie mamy tego ograniczenia, bo holografia sama w sobie daje dostęp do trójwymiarowego rozkładu. Co ciekawe, holografia została już dawno temu zaproponowana. W tysiąc dziewięćset czterdziestym ósmym roku Dennis Gabor napisał świetny artykuł o New Microscopic Principle opublikowany w „Nature”. Ten artykuł miał korygować aberrację sferyczną mikroskopu elektronowego, a okazało się, że holografia nigdy nie została do tego zastosowana, ale została do wielu innych rzeczy. W tysiąc dziewięćset siedemdziesiątym pierwszym roku dostał za to Nagrodę Nobla. Co zabawne, Gabor był na tyle świadomy, że nawet w abstrakcie swojego manuskryptu napisał dwa zdania, że to może się nie udać, podając konkretne przyczyny. Generalnie miał rację. W nauce często jest tak, że robimy coś, co nam się wydaje, że ma jedną aplikację tu i teraz, a za kilka lat okazuje się, że jest Nobel i otwiera się zupełnie nowa dziedzina. I my korzystamy dokładnie z tej Gaborowskiej holografii, czyli poosiowej. Tak jak opowiadałem, fala propaguje się ze źródła światła do próbki i potem z próbki do kamery. To jest wszystko ustawione w jednej linii.
K.G.: Myślę, że jest to szalenie ciekawe i ważne, szczególnie jeśli chodzi o tę możliwość szerszego spojrzenia. Bo opowiadałeś mi, zanim zaczęliśmy nagranie, że to jest jakiś gigantyczny problem. To znaczy, biolodzy przygotowują sobie ileś, czasami set tysięcy komórek, a korzystając z aktualnych możliwości ich obserwowania, ilu z nich mogą się przyjrzeć dokładnie?
M.T.: Najczęściej jest to pole osiemdziesiąt na osiemdziesiąt mikrometrów. Komórka w swoim wymiarze ma z dwadzieścia mikrometrów.
K.G.: To raptem kilka komórek.
M.T.: Tak. I trzeba mieć dużo szczęścia, żeby trafić akurat na takie komórki, które zachowują się w sposób ciekawy dla nas. Więc ja lubię myśleć o mikroskopii bezsoczewkowej tak, że maksymalizujemy prawdopodobieństwo, że coś ciekawego zobaczymy, bo analizujemy całą kolonię komórek, nic nam nie umyka. I w związku z tym, że to robimy, minimalizujemy prawdopodobieństwo, że popełnimy błąd. Bo jeżeli wie się na jakiś temat mało, a zaczyna się wnioskować, to rośnie prawdopodobieństwo, że się popełni błąd. Eric Betzig, o którym wspomniałaś, miał ostatnio bardzo fajny wykład o sfrustrowanym mikroskopiście. Nie przebierając w słowach, powiedział, że sam jest współautorem jednej pracy, która ma już dziewięćset cytowań, gdzie przebadali słownie jedną komórkę. A potem ta praca w swojej drugiej części ma jakieś wnioski na temat biologii komórki ogólnie, co jest absolutnie bez sensu.
K.G.: Mogą być przecież fałszywe wnioski, bo mogła być np. jakaś aberracja. To nawet nie musi być jakiś większy mechanizm. Zawsze naukowcy opowiadają mi o tym, że statystyka jest najbardziej istotna.
M.T.: Dokładnie. A ten gość dostał Nobla. Ale się z tego wyspowiadał. [śmiech] Tak że polecam go, bardzo fajny. A w ogóle swój nanoskop zbudował we własnym salonie, będąc bezrobotnym czy na granicy bezrobocia. Nigdy nie prosił o żaden grant.
K.G.: Nie wolno mówić takich rzeczy, bo zaraz usłyszą to rządzący i powiedzą: aha, czyli dalej możemy głodzić naukowców. [śmiech]
M.T.: Nie, nie, wręcz przeciwnie – Eric Betzig nigdy nie musiał prosić o pieniądze, bo zawsze miał dużo pieniędzy, bo finansowały go bardzo potężne ośrodki i potężni gracze. Zawsze był bardzo dobrze finansowany.
K.G.: Jeszcze cię wypytam o to finansowanie, bo kwestia takiego grantu jak ERC jest bardzo ciekawa, natomiast chciałabym sobie wyobrazić, że udaje wam się stworzyć to urządzenie NaNoLens. I gdzie ono stoi? W superspecjalistycznych centrach badawczych czy w szpitalach, centrach diagnostycznych? Jak to sobie wyobrażacie?
M.T.: Mam nadzieję, że wszędzie. Chciałbym to rozgraniczyć – granty ERC to są granty na badania podstawowe, z których może coś wyjść. Mam plan, żeby coś wyszło. Ale granty ERC Proof of Concept dotyczą prób komercjalizacji, o które też będę aplikował, ale jeszcze tego nie zrobiłem. Oczywiście myśli się o tym potencjale aplikacyjnym, jednak sam projekt NaNoLens dotyczy zapoczątkowania nowej dziedziny nauki, czyli tej nanoskopii bezsoczewkowej. Czyli obrazować coś z wysoką rozdzielczością i jeszcze w 3D.
K.G.: Czyli ma być przełom.
M.T.: Tak. [śmiech] W tych projektach tak. Trzeba mieć bardzo solidne podstawy do tego, żeby marzyć. Bardzo bym chciał, żeby stało to wszędzie, w tym m.in. w komorach inkubacyjnych, bo biolodzy bardzo lubią te komórki, mają taki sentyment do nich, więc dbają o nie. Umieszczają je w komorach, gdzie mają odpowiednią atmosferę, wilgotność. I dobrze, żeby można je było tam podglądać. Wtedy by zupełnie nie było żadnego stresu. Takie obrazowanie przyżyciowe, zupełnie bezstresowe. I te mikroskopy mają być małe, kompaktowe, bo są złożone tylko ze źródła światła, próbki i kamery. Można je w taki zgrabny sposób pakować i nawet wstawić do tej komory inkubacyjnej. Rozwiązania mikroskopii bezsoczewkowej są też – nie chcę powiedzieć „tanie” – ale ekonomicznie okej, bo mamy mało elementów. I to też jest duży plus. Można by było pomyśleć o takim rozwiązaniu, na które byłoby stać więcej osób. Dlatego rozpocząłem odpowiadanie od tego, że chciałbym, żeby stało to wszędzie, żeby po prostu nie było to drogie. A te mikroskopy z soczewkami są bardzo drogie.
K.G.: Co może nam to dać jako pacjentom? Wyobrażam sobie, że można wziąć próbkę np. z mojego ciała, bo jest coś niepokojącego i co? Pyk pod taki NaNoLens i on nam coś powie szybciej niż teraz?
M.T.: Jak wszystko pójdzie okej, to tak. Plan jest taki, żeby obrazować w dużym polu widzenia, czyli żeby naraz analizować całą próbkę, bez skanowania. Jak to się skaluje? Nasz NaNoLens działałby jak ponad dziesięć tysięcy takich mikroskopów dostępnych teraz, jeżeli chodzi o samo pole widzenia. Więc moglibyśmy myśleć w ten sposób pozytywnie, że zrobimy coś dziesięć tysięcy razy szybciej, ale najważniejsze jest to, że nie stracimy tej informacji, że obrazujemy całą hodowlę komórkową i nie stracimy żadnej informacji, więc maksymalizujemy prawdopodobieństwo odkryć naukowych. Odpowiadając na pytanie, co to może dać, w swoim projekcie ERC musiałem wskazać jakąś aplikację, mimo że uważam, że – jak się uda – tych aplikacji będzie bardzo dużo. Jedną wskazałem. Jest to obrazowanie pęcherzyków zewnątrzkomórkowych. Te pęcherzyki to takie małe, stupięćdziesięcionanometrowe sfery lipidowe, które mają w środku jakąś informację.
K.G.: Czyli takie kuleczki tłuszczowe?
M.T.: Tak. Okazuje się, że każda komórka to jest całkiem nowa sprawa. Każda komórka produkuje takie pęcherzyki (po angielsku extracellular vesicle – w skrócie EVs). Produkują je one w konkretnym celu – żeby się ze sobą komunikować. Jest teraz dużo prac, które analizują manifestację tych EVs w organizmie, w tzw. biopsji płynnej, czy możemy pobrać krew od pacjenta i nie tylko badać te komórki lub jakieś biochemiczne markery, tylko też np. zacząć zliczać te pęcherzyki zewnątrzkomórkowe. Kolejna aplikacja takich pęcherzyków to może być dostarczanie leków. No bo przez to, że są naturalnie produkowane w komórkach, ich podróż zaczyna się w jednej komórce, a kończy w drugiej. Tak że komórki je lubią i pozwalają, żeby one wchodziły z jednej komórki do drugiej. Więc możemy upakować w nich jeszcze jakieś leki, co próbuje robić pani profesor Mierzejewska z Politechniki Warszawskiej, którą serdecznie pozdrawiam. Hoduje te EVs z drożdży i próbuje sprawdzać, jak one są inkorporowane przez inne komórki. To, co NaNoLens mógłby umożliwić, to obserwowanie na żywo, jak te EVs są produkowane przez komórki, jak się przemieszczają w całej hodowli komórkowej i gdzie lądują. I to wszystko bez znaczników.
K.G.: To duża rzecz.
M.T.: Tak, to by pozwoliło na nowe bardziej dynamiczne spojrzenie na te produkcje i asymilacje pęcherzyków zewnątrzkomórkowych. To jest motywacja biologiczna i medyczna.
K.G.: Czytałam o tych pęcherzykach zewnątrzkomórkowych, że to jest superobiecująca sprawa. Są też pomysły dotyczące szczepionek.
M.T.: Tak. Ja się na tym zupełnie nie znam, ale w związku z tym, że tam w środku jest jakaś informacja, chyba mRNA, ale nie chcę używać mądrych słów, których nie znam. Wydaje mi się, że jest ogromna szansa, że można by było przyczepiać fizycznie jakieś leki czy nawet kodować sposób, w który tak lokalnie mielibyśmy taką inżynierię genetyczną. Czyli te pęcherzyki uwalniałyby informację, a ona by docierała i powodowała jakieś określone zmiany.
K.G.: A nie ma cenniejszej rzeczy dla farmacji niż to, żeby dostarczać leki bardzo, bardzo precyzyjnie. To jest zawsze cenne. Czyli ty jesteś takim inżynierem, który chce przygotować narzędzie, pójść z tym do biologów, lekarzy i powiedzieć: macie, korzystajcie?
M.T.: Tak. Bardzo serdecznie pozdrawiam wszystkich biologów, z którymi współpracuję. Są oni dla mnie źródłem nieskończonej inspiracji i próbek, na których możemy testować we wczesnych stadiach te swoje rozwiązania. Tak, jestem inżynierem, trochę też fizykiem, ale nie mam na to żadnych papierów. Jak mówi Eric Betzig, czasami przebiera się za biologa. Ja chyba jeszcze nie umiem, ale chciałbym. No i raz w życiu był on chemikiem – jak dostał Nagrodę Nobla z chemii. Ja chemikiem jeszcze nigdy nie byłem.
K.G.: Ja cię tak wypytuję o te kwestie związane z pacjentami, bo słyszałam w wywiadzie z tobą u redaktora Wiktora Niedzickiego na YouTube, że przedstawiłeś taką wizję, że na sali operacyjnej chirurg wycina kawałek nowotworu i mógłby od razu sprawdzić, czy jest wycięte tyle, ile trzeba. To by było ekstra.
M.T.: Tak, to jest taki święty Graal. Tylko to dotyczy badania tkanek. Do tej pory mówiliśmy o badaniu komórek. Tkanka to jest takie bardzo mocne opakowanie różnych komórek. W związku z tym, że to opakowanie jest silne, mamy więcej tego rozpraszania, o którym też wspomnieliśmy, i nie jesteśmy pewni, czy akurat ta metoda holografii Gabora, która potrzebuje małego rozpraszania, by działała. To są takie fundamentalne pytania, które też stawiamy w grancie ERC. Chcielibyśmy zbadać, kiedy to rozpraszanie jest za duże, kiedy jest za małe. Można optycznie oczyścić, są takie metody szybkiego oczyszczania tkanek. Projekt NaNoLens dotyczy bardziej tych komórek, pęcherzyków zewnątrzkomórkowych, czyli czegoś mniej upakowanego. Żeby to światło przechodziło troszeczkę w mniej zaburzony sposób. Bo jednak tkanki to są już wielokrotne rozpraszania, to są zupełnie inne algorytmy. Ale tak, są też inne projekty. Akurat ten to projekt Lider finansowany przez NCBR i tam chcemy właśnie analizować tkanki, co jest zupełnie różne niż te komórki. Święty Graal jest taki, żeby nawet w trakcie operacji szybko podejrzeć, czy ta tkanka wygląda tak, jak powinna wyglądać, czy ten margines jest zachowany, bo histopatolog często musi czekać na bardzo ważne wyniki, o czym sam też się przekonałem w poprzednim roku. Dwa tygodnie – to strasznie stresująca sprawa. Jak pobieramy wycinek w trakcie operacji od pacjenta, to żeby on wylądował u histopatologa, który to ocenia, trzeba go najpierw odpowiednio przygotować i pokroić na plasterki, mówiąc obrazowo. I te plasterki są potem oglądane. Z różnych powodów ich krojenie może nam nie wyjść, bo np. za cienko pokroiliśmy, bo był zbyt kruchy materiał, np. fragmenty płuc są bardzo kruche i trzeba je grubiej kroić. I nawet sam sposób takiego szybkiego wskazania, który z tych przygotowanych plasterków ma informacje, czy w ogóle warto na niego spoglądać, już by to przyspieszył – średnio takich skrawków jest robionych trzydzieści, pięćdziesiąt z pobranego materiału.
K.G.: To znacząco by przyspieszył.
M.T.: Bardzo byśmy chcieli to zrobić, ale mówiąc o marzeniach – bo bardzo dużo dzisiaj mówię o swoich marzeniach, to jest wszystko w sferze marzeń moich i mojego zespołu – chciałem bardzo podziękować swojemu zespołowi. To są bardzo utalentowani ludzie i wszystko, o czym mówię, to są nasze wspólne osiągnięcia lub plany. Bardzo, bardzo chciałbym wszystkim podziękować, jestem megadumny, to moje duże osiągnięcie, że mogę z takimi utalentowanymi ludźmi pracować i daje to nadzieję, że może nam się to wszystko uda. No i ten święty Graal, czyli szybka biopsja z oceną histopatologiczną w trakcie, to by było super.
K.G.: Powiedz jeszcze – NaNoLens ma w efekcie dawać nam zdjęcia czy może filmy tego, co się dzieje?
M.T.: Filmy są w planach. Odpowiadając technicznie na to pytanie, do śledzenia tych EVs, tych mikropęcherzyków wystarczy nam jeden hologram, żeby zrekonstruować całą objętość. Jeden hologram wystarczy, żeby śledzić. Do obrazowania 3D, do tej tomografii, od której zaczęliśmy, trzeba oświetlać z wielu kierunków. Tak samo jak w tym tomografie też z wielu kierunków jest naświetlenie i wtedy rekonstrukcja jest prowadzona. Ale do takiego śledzenia jak najbardziej możemy to zrobić bardzo szybko, co już robimy. Mamy algorytm, który się nazywa Dark Track, bo wykorzystuje takie ciemne pole konstruowane numerycznie, gdzie śledzimy – akurat w tym wypadku śledziliśmy plemniki. To jest też bardzo ważne, jak one się poruszają, żeby wybrać odpowiedni np. do różnych metod leczenia bezpłodności.
K.G.: Tradycyjnie dałam znać patronom i patronkom Radia Naukowego, że będę z tobą rozmawiać, bo zawsze informuję ich o tym, jakie są plany i pytam, czy mają pytania. Jedna z nich, pani Kasia, z tego, co wiem, z branży – pozwolę sobie tak powiedzieć – bardzo zajarana tym tematem, napisała: „Mam wrażenie, że to zrewolucjonizuje nauki biologiczne, podobnie jak USG zmieniło diagnostykę medyczną. To też badania nieinwazyjne, nieszkodliwe, a pokazujące dotychczas ukryte struktury”. Co ty na to?
M.T.: Fajne porównanie. Też wykorzystujemy w USG promieniowanie, akurat z innego zakresu. Problemy podobne do USG, które mogą wynikać, są takie, że możemy nie mieć tej specyficzności. W barwieniu fluorescencyjnym poświęcamy czas na to barwienie ze wszystkimi wadami, ale jest ogromna zaleta tego, że jak coś się świeci, mówiąc wprost, na czerwono, to wiemy, że to się musiało przyczepić do konkretnej struktury. Więc mamy specyficzność obrazowania, wiemy, na co patrzymy. Tutaj, w mikroskopii holograficznej bezsoczewkowej, jak fala podróżuje przez próbkę, wszystko, każde rozproszenie, z każdego powodu, każda zmiana tej fali jest źródłem sygnału dla nas. Musimy się bardzo napocić, żeby zrekonstruować z jak najmniejszą liczbą błędów, artefaktów i żeby jeszcze jakoś to połączyć z szansą na specyficzność. W tym celu są na świecie szeroko wykorzystywane, m.in. przez grupę profesora Özkana, który też bardzo, bardzo prężnie działa w mikroskopii bezsoczewkowej, metody uczenia maszynowego. Żeby to maszyny decydowały, jak ten kontrast powinien finalnie wyglądać. Czyli nie barwimy fizycznie, ale barwimy z wykorzystaniem tych sieci neuronowych, do czego trzeba podchodzić z rezerwą moim zdaniem. Ja się wywodzę z interferencji, z meteorologii i tam dużą wagę przykładaliśmy do pomiarów, do tego, żeby być pewnymi, na co patrzymy, do rozdzielczości, do weryfikacji. No a te sieci neuronowe lubią też troszeczkę halucynować, malować.
K.G.: Nie lubią się przyznawać, że nie wiedzą.
M.T.: Jakiś wynik zawsze dadzą. Może wygląda to bardzo podobnie do wyników barwienia, ale jak się zaczniemy przyglądać konkretniej, to pojawiają się, przynajmniej na moje oko, problemy. Ale jest to też droga, którą chcielibyśmy eksplorować. Mamy sieci neuronowe, nad którymi pracuje pani doktor Maria Cywińska u mnie w grupie. I chcielibyśmy też takie próby podejmować, ale podejmujemy je w sposób meteorologicznie okej, czyli nie dajemy sieci dużego pytania: słuchaj, zrób mi całe obrazowanie, tylko przyspiesz fragment procesu rekonstrukcyjnego – który jest często długi i żmudny – żeby przyspieszyć, ale zminimalizować szanse na to, że jednak będziemy mieli tym razem złe wnioskowanie przez to, że mamy sieć neuronową, która nam przeszkodzi.
K.G.: Pani Katarzyna zapytała też: „Czy możliwe jest stosowanie tej technologii nie tylko do pojedynczej warstwy komórkowej? Czy istnieje szansa na badania na organoidach?”. Organoidy to są takie małe organy.
M.T.: Tak – to żyje, składa się z komórek i organizuje dostęp do takich próbek. Tego nie będzie w tym projekcie ERC, bo mamy wyższe rozpraszanie. Jeżeli ta próbka jest grubsza niż jedna warstwa komórek, to tam jest więcej tego rozpraszania. To się teraz bardzo rozwija – obrazowanie przez ośrodki silnie rozpraszające. Widziałem fajne wyniki obrazowania fazowego, jednak w naszym wypadku jeszcze nie dostaliśmy takich wyników. Na pewno trzeba będzie popracować nad koherencją oświetlenia, w co może nie będziemy się zagłębiać, ale to jest na pewno bardzo ważny cel. Na pewno w tę stronę rozwija się cała działka obrazowania. Bardzo znani naukowcy dostają wiele pieniędzy właśnie na to – żeby obrazować nieinwazyjnie i jak najgłębiej.
K.G.: Jeszcze jedno pytanie – czy komórki do NaNoLens mają być hodowane w medium obojętnym dla użycia tych fal, czy też standardowe pożywki nie dają zakłóceń? Pożywki, bo komórki trzeba na czymś hodować, trzeba im dać pożywkę.
M.T.: Jeszcze często na jakimś podłożu. Kolejna seria pozdrowień dla pań doktor z Instytutu PAN. Też się musiałem nauczyć tego wszystkiego. Są jakieś podłoża, które te komórki lubią, jakieś szkiełka czy elementy materiału, na których są te podłoża, na których są te komórki. Potem są pożywki. Często korzystamy z takich różowych pożywek. Zastanawialiśmy się, jak to wpływa. Doszliśmy do wniosku, że ten materiał, na którym musimy hodować, musi być jak najbardziej przezroczysty, żeby nie zakłócał. Bo jak już wspomniałem, jak tylko fala podróżująca przez próbkę zmieni się w jakikolwiek sposób, to jest to sygnał. Chcielibyśmy, żeby tylko próbka zmieniała.
K.G.: Ale nie możecie tego skorygować, skoro wiecie, że to jest różowe?
M.T.: W tym wypadku sama pożywka ma menisk – tak jak w szklance, jest menisk wypukły i wklęsły. Warstwa cieczy nie jest pozioma, tylko albo w dół, albo w górę. Zależy od napięcia powierzchniowego. Jeżeli jest wygięta, to wprowadza globalne zakłócenia do naszej wiązki. Ta wiązka przestaje być globalnie płaska, tylko staje się sferyczna. To da się korygować na gruncie tej propagacji, czyli my i tak imitujemy to, co się dzieje naprawdę w wolnej przestrzeni. Możemy to imitować w troszeczkę inny sposób i też się dostrajamy. Są te wszystkie możliwości korekcji. Tylko musimy zacząć od czegoś, co będzie jakkolwiek widoczne. Jeżeli tego rozpraszania będzie tak dużo, bo np. na plastikowym filmie, granularnym szkiełku będziemy to hodować, to będzie już zbyt dużo tego rozpraszania. Ale generalnie korygujemy numerycznie bardzo dużo rzeczy. Tak że to jest bardzo słuszna uwaga.
K.G.: Jak się dostaje grant ERC? Co trzeba zrobić? Pojechać na rozmowę kwalifikacyjną?
M.T.: To jest skomplikowany i długi proces. Trzeba napisać wniosek, który ma dwie główne części – B1 i B2. W B1 krótko się pisze o sobie i o swoim pomyśle. Siadają tzw. generaliści, w panelu jest dwadzieścia osób i na podstawie tych kilku stron albo jest się zakwalifikowanym do dalszego etapu, albo nie. I dopiero ten drugi etap polega na rozmowie, prezentacjach. Tak że trzeba mieć dobry pomysł. Teraz to się zmienia, mówię, jak było w poprzednim roku – to było fifty-fifty. Pomysł i sylwetka badawcza. Co do tej sylwetki badawczej, u mnie poskutkowało to – trzeba sobie samemu trochę nakłamać w ten sposób, że słowo „porażka” ma inne znaczenie. Żeby była szansą. Bo tych porażek u nas w życiu naukowca jest bardzo dużo – np. mamy pomysł, który okazał się zły. I to jest porażka. A nawet jak pomysł okaże się dobry, to np. symulacje wyjdą, a eksperyment już nie. I to też słabo. Ale nawet jak nam wszystko wyjdzie, to wysyłamy manuskrypt do publikacji w czasopiśmie i tam już edytor mówi, że nie, w ogóle nie ma szans. Albo potem wysyła do recenzentów i tzw. recenzent drugi się do czegoś przyczepi. Piszemy ciągle wnioski grantowe, siedząc po nocach, które też są recenzowane, i większość nie przechodzi. Różni ludzie mają różne współczynniki sukcesu. Ja mam niższy niż wyższy.
K.G.: Czyli to jest też jakaś psychologia dla badacza – musiałeś spojrzeć na siebie sam z zewnątrz i powiedzieć: jestem super, zasługuję na ten grant?
M.T.: Na pewno nie mam czegoś takiego jak impostor syndrome, ale też nie mam tej drugiej strony, że jestem nie wiadomo jak pewny siebie. Lubię to, co robię. Jest to moją pasją. Najwięcej musiałem pracować sam ze sobą i ze swoim zespołem nad tymi porażkami, bo jest ich po prostu bardzo dużo i musi to być przedefiniowane na szanse. Na szanse, żeby może mieć lepszy inny pomysł, może do innego czasopisma wysłać, może inny projekt napisać. Wszystko jest szansą.
K.G.: A myślisz, że to może być trochę kulturowe? To znaczy, w Polsce może mniej chętnie się reklamujemy, bo może być to odebrane – albo się tego obawiamy – jako chwalipięctwo, wywyższanie się. A wydaje mi się, że na Zachodzie autopromocja jest milej widziana.
M.T.: Wydaje mi się, że na pewno są w Polsce ludzie, którzy są bardzo dobrzy w kreowaniu swojego wizerunku, opowiadaniu o sobie i swoich badaniach, ale taki ogólny poziom jest dużo wyższy we Francji czy u naszych zachodnich sąsiadów. Tam jakby oni mieli jakieś szkolenia, o których my nie wiemy, z tego, jak sprzedawać. Bo to jest też bardzo ważne, żeby mieć dobry pomysł, finansowanie, zrobić ten wynik i potem ma się manuskrypt, ma się ładne rysunki, i trzeba to gdzieś opublikować. To też jest samo w sobie jakimś procesem, który trzeba umieć robić. Czyli trzeba mieć znajomości, trzeba się znać z edytorami. Często jest tak, że wydaje nam się, że to jest bardzo dobry artykuł, a niestety nie trafia do takiego czasopisma z różnych przyczyn, chociaż wydawało nam się, że powinien trafić. A w tych czasopismach widzimy artykuły, które nie są tak dobre. Generalnie jest taka trochę dziwna zasada, że jest dziedziczony prestiż, czyli jak coś jest opublikowane w jakimś czasopiśmie, to jest to tak dobre, jak to czasopismo. Jest to troszeczkę absurdalne, bo trzeba przeczytać ten artykuł i odnieść się do osiągnięcia. Ale wchodzimy tu już na zupełnie inne pole ewaluacji.
K.G.: To jest bardzo ciekawe, bo mnie i słuchaczy Radia Naukowego bardzo ciekawi to, jak się żyje naukowcom. I wychodzi na to, że przede wszystkim jest się badaczem, ale jest się też twórcą, kiedy jest się inżynierem takim jak ty, który chce stworzyć coś zupełnie nowego. Więc ja to widzę w kategoriach twórczych. Ale do tego trzeba być własnym PR-owcem i marketingowcem.
M.T.: Tak, i jeszcze kilka innych rzeczy – np. trzeba rekrutować ludzi, czasami sporządzać im umowy, jakieś kwestie podatkowe, organizacyjne, administracyjne, ogólne. I jeszcze jak chce się np. coś kupić, to trzeba być specjalistą z zakresu zamówień publicznych, np. laser kupuje się rok. To już jest dla mnie zbyt obciążające psychicznie, żeby ciągle o tym myśleć przez rok, dlaczego on jeszcze nie przyszedł. Tak że tych etatów, na których jesteśmy, jest na tyle dużo, że pisanie projektów bardzo rzadko dzieje się w ramach godzin pracy. Projekty piszemy najczęściej w nocy, jak już dzieci pójdą spać i spokojnie się w domu zrobi.
K.G.: Ja to znam z odpowiedzi mailowych, bo zapraszamy naukowców i naukowczynie i często czytamy: później, bo teraz piszę grant – i właśnie często po nocach przychodzą te maile. Ale jeszcze wracając do ERC – to jest trochę jak obrona pracy doktorskiej, to znaczy, że wcześniej znałeś pytania czy byłeś totalnie zaskoczony w czasie tej rozmowy na drugim etapie?
M.T.: Pytania nie są znane. Są jakieś takie ogólne, których można się spodziewać, są też dobre rady od ludzi, którzy już dostali granty. I jeden mówi tak, drugi inaczej, a wychodzi jeszcze co innego. Mój panel był o tyle specyficzny, że było wtedy bardzo ciepło. Panel jest online – rejestruje się i jest się w wirtualnej poczekalni. Jest zegar, czas leci i albo cię wpuszczą, albo nie. To jest troszeczkę imitacja tej fizycznej poczekalni w Brukseli, gdzie kiedyś się jeździło. Teraz się siedzi przed komputerem i patrzy, jak zegar odlicza od trzydziestu w dół. I jak odliczy te trzydzieści minut, to jest się wypraszanym i ponownie trzeba się zalogować. Zostało dwadzieścia sekund i dostałem komunikat: nie zaproszono cię, więc zostaniesz wylogowany. I mój sąsiad zaczął coś krzyczeć, nie wiem, z jakiego powodu, były pootwierane okna, bo było ciepło, więc poszedłem zamknąć okno. Wróciłem i tam już wszyscy na mnie czekali i się śmiali. Było ciepło, więc miałem krótkie spodenki, które mogły wyglądać jak piżama. Miałem też dosyć wzorzystą koszulę. Ale zobaczyłem, że przewodniczącym panelu jest profesor, którego nie znałem wcześniej, ale znam jego prace i bardzo go cenię, i jakoś postaraliśmy się rozładować atmosferę żartem – zaśmiali się, powiedzieli, że ładne spodenki, ja powiedziałem, że ładna koszula, bo też miał wzorzystą. I jakoś się wszystko rozładowało, ale byłem strasznie zestresowany. Potem było pięć minut prezentacji i nie widziałem zegara. Bardzo nie lubią, jak się przedłuża, więc trzeba było skończyć dokładnie po pięciu minutach. Ćwiczyłem tę prezentację i udało mi się skończyć w pięć minut. Byłem przygotowany na bardzo konkretne pytania. Wszyscy mówili: oni cię tam zgrillują, wszystko wiedzą na temat twojego projektu, musisz się przyznać do wszystkich błędów i naciągnięć. I pierwsze pytanie, jakie dostałem, to jakie są ograniczenia nauki, techniki, które będą wpływać na mój projekt.
K.G.: To jakbym ja ci takie pytanie zadała. [śmiech] Taki poziom ogólności.
M.T.: Troszeczkę mnie zatkało, ale na szczęście udało się dwa razy poprosić o powtórzenie pytania, a potem o jego rozbicie na części składowe i potem stało się jasne, co autor pytania miał na myśli, bo na początku zupełnie nie wiedziałem, od której strony zacząć odpowiedź.
K.G.: I co, rozłączyłeś się i pomyślałeś sobie: e-e?
M.T.: No, pomyślałem sobie, że nie poszło. Ale to nie jest takie ważne, żeby to dobrze poszło. Bo ranking jest już wcześniej ustalony. Z insiderskich informacji wiem, że bardzo ważny jest dzień, w którym się jest zaproszonym na rozmowę, bo ranking w poniedziałek to są ludzie, którzy raczej dostaną, w piątek to ci, którzy nie. Ja byłem zaproszony chyba we wtorek. I czterdzieści procent osób dostaje. Ja byłem pod koniec wtorkowego dnia i udało się utrzymać tę pozycję. Dlaczego mówię, że to nie jest takie ważne? Bo jeżeli są problemy z połączeniem, to często jest to przeprowadzane telefonicznie. Wtedy nie ma prezentacji, bo nie ma jak puścić slajdów. Kilka razy się zdarzyło, że telefoniczne połączenia też nie doszły do skutku. I wtedy panel oceniał na podstawie dokumentów, które miał. Tak że to nie jest konieczne, żeby dostać ten grant. Ale nie pomagają krótkie spodenki, które wyglądają jak piżama. A może właśnie pomagają, skoro dostałem. [śmiech]
K.G.: Słucha nas też wielu naukowców, którzy notują, bo może jest jakaś tajna grupa ludzi, którzy dostali granty ERC, i opowiadają, co robić, a czego nie. Bo to trochę tak brzmi, jakby była grupa tych już oświeconych. [śmiech]
M.T.: Nie czuję się w żaden sposób oświecony. [śmiech] Chciałem powiedzieć jak na spowiedzi, jak to u mnie wyglądało. Sami państwo słyszycie, że to z profesjonalizmem nie miało nic wspólnego. [śmiech] Trzeba próbować.
K.G.: Grant jest na kilka lat. Ciekawi mnie, jak wygląda twoja praca tak na co dzień. Przychodzi się do pracy w poniedziałek i co? Bo dlaczego np. to trwa pięć lat?
M.T.: Akurat agencja tak sobie wymyśliła, że będzie finansować przez pięć lat. Granty finansowane przez Narodowe Centrum Nauki, dzięki którym w ogóle mogłem zbudować zespół, dzięki którym miałem szansę na grant ERC, były krótsze. Mój pierwszy grant Preludium był dwuletni, potem Opus, który składałem jeszcze jako doktorant, czyli wnioskowałem jeszcze przed obroną doktoratu i udało się go utrzymać, był trzyletni. Teraz kończę czteroletni Opus i trzyletnią Sonatę. Ustala to rada danej agencji. A jak wygląda mój tydzień? Często trzeba sobie i wszystkim powtarzać o tych szansach, o których mówiłem, że to nie jest porażka. Trzeba po prostu zmienić swój mindset. My się ciągle uczymy. No i druga sprawa, że jest wyczynowa praca. Po prostu trzeba to wszystko zrobić. Można też brzydko powiedzieć, że trzeba wysiedzieć dupogodziny w laboratorium, ale to jest prawda. Trzeba to wszystko zrobić i jak się skumuluje pracę, połączy się z dobrym pomysłem i potem jeszcze z marketingowymi talentami do sprzedaży, których się ciągle uczę, to ukazuje się taka publikacja, których jest coraz więcej – np. moi koledzy z UW bardzo często publikują w „Nature” i „Science”. Tak że Polak potrafi w całkowicie zrobione w Polsce badania. I często się składa, że są one z zakresu fotoniki i optyki, o której rozmawiamy. Były w tym roku dwa granty – Starting dostałem ja i kolega Łukasz Sterczewski z Wrocławia też z fotoniki dostał na lasery terahercowe, w których się specjalizuje. Tak że Polska fotoniką stoi.
K.G.: A dlaczego w zasadzie jesteś w nauce?
M.T.: Bo lubię zadawać pytania i szukać na nie odpowiedzi. No i też dlatego, że trafiłem na doskonałych mentorów. Już w liceum miałem świetnego nauczyciela fizyki, mojego wychowawcę, którego pozdrawiam. Mam też świetnych współpracowników międzynarodowych. Po prostu jestem ciekawy, od początku chciałem zadawać swoje pytania. Bardzo ważne jest, żeby mieć swoje finansowanie i wokół siebie budować tematykę, wokół tej tematyki budować zespół i z tego jestem bardzo dumny. Jeszcze raz pozdrawiam wszystkich moich współpracowników.
K.G.: I NCN pozdrawiamy.
M.T.: Tak, i cieszymy się, że pozdrawiamy NCN bogatszy o dwieście milionów. To dobry kierunek. Apeluję o podwojenie budżetu. Wydaje mi się, że warto inwestować w takich ludzi, którzy coś już widzieli, coś osiągnęli. I takie wyspy talentu byłyby super.
K.G.: Kończąc i całą naszą rozmowę, i ten wątek dotyczący NCN-u – naprawdę wiele razy o tym rozmawiałam albo w środowisku naukowców często pojawia się ten wątek, że NCN albo kogoś w Polsce zatrzymał, albo nawet ściągnął z powrotem. Tak że się da.
M.T.: Brain gain teraz się pojawia, czyli jakbyśmy mieli więcej pieniędzy, to moglibyśmy właśnie ściągać tych ludzi, których straciliśmy, a współczynnik sukcesu na poziomie ośmiu procent…
K.G.: Osiem procent wniosków?
M.T.: Tak, osiem na sto wniosków. Bardzo często jest nawet połowa sensownych wniosków. A już na pewno jedna trzecia czy jedna czwarta to są świetne pomysły, z których większość nie zostanie sfinansowana. I najprawdopodobniej właśnie te pomysły wraz ze swoimi autorami wyjadą z kraju.
K.G.: Ale profesor Maciej Trusiak jest na Politechnice Warszawskiej i szykuje dla nas wszystkich, dla ludzkości NaNoLens-y.
M.T.: Tak. Zabrzmiało to bardzo górnolotnie. [śmiech] Dużo mówiłem o marzeniach. Trzeba marzyć i mieć te swoje cele. Mam nadzieję, że wiele się uda osiągnąć w samej drodze do tego celu. Chociaż ten cel jawi się może troszeczkę daleko, ale sama droga będzie na pewno bardzo fajną przygodą i dużo ciekawych rzeczy można wspólnie z moimi współpracownikami zrobić i jeszcze raz im wszystkim bardzo dziękuję za to, że możemy działać razem.
K.G.: Ja też dziękuję i pozdrawiam serdecznie. Dzięki za rozmowę.
M.T.: Dzięki serdeczne. Pozdrowienia.
Zobaczcie, jak pracuje zespół prof. Trusiaka:

Laureat ERC Starting Grant, prestiżowego grantu przyznawanego przez Europejską Radę ds. Badań Naukowych projektom o pionierskim charakterze, przekraczającym obecne granice wiedzy. Pracuje w Instytucie Mikromechaniki i Fotoniki na Wydziale Mechatroniki Politechniki Warszawskiej. Zainteresowania naukowe: mikroskopia obliczeniowa, obrazowanie komórek i tkanek, interferometria, przetwarzanie i analiza danych, cyfrowa mikroskopia holograficzna, biofotonika, algorytmy numerycznej rekonstrukcji, ilościowe obrazowanie fazy, mikroskopia bez znaczników.
Kieruje Quantitative Computational Imaging Lab